微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (12分)实验室需要配制0.1 mol/L NaOH溶液450 mL,回答下列问题:

(1)如图所示的仪器中配制溶液肯定不需要的是 (填序号),
配制上述溶液还需用到的玻璃仪器是 (填仪器名称);
(2)下列操作中,容量瓶所不具备的功能有 (填序号)。
A.配制一定体积准确浓度的标准溶液
B.贮存溶液
C.测量容量瓶规格以下的任意体积的液体
D.用来加热溶解固体溶质
(3)根据计算用托盘天平称取NaOH的质量为 g;
(4)取用任意体积的所配0.1 mol/L NaOH溶液时,下列物理量中不随所取体积的多少而变化的是(填字母) ;
A.溶液中NaOH的物质的量 B.溶液的浓度
C.溶液中Na+的数目 D.溶液的密度
(5)将所配制的NaOH溶液进行测定,发现浓度大于0.1mol/L。请你分析下列哪些操作会引起所配浓度偏大(填写字母) 。
A.烧杯未进行洗涤
B.配制前,容量瓶中有少量蒸馏水
C.NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中,并进行定容;
D.往容量瓶转移时,有少量液体溅出
E.在容量瓶中定容时俯视容量瓶刻度线
F.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线。
参考答案:(1)A C , 烧杯 玻璃棒; (2)B C D(3)2.0 g (4)B D (5) C E
本题解析:(1)用固体配制溶液时用到的仪器有托盘天平、烧杯、容量瓶、玻璃棒、胶头滴管等,平底烧瓶和分液漏斗不需要,量筒可用可不用,还要用到的有烧杯 、玻璃棒。(2)容量瓶只是用来配制溶液,不能贮存溶液,也不能量取溶液,更不能加热,选B 、C 、D(3)由于没有450mL规格的容量瓶,故容量瓶选用500mL,n(NaOH)=c×V=0.1 mol/L×0.5L=0.05mol,NaOH的质量为:m=n×M=0.05mol×40g/mol=2.0g。(4)量取的溶液越多,所含溶剂的总质量就越多,溶液配制好后浓度与量取的体积无关;量取的体积越多Na+的数目越多,密度也与量取的体积无关,选B 、 D(5)A、烧杯没有洗涤会造成转移到容量瓶中的NaOH减少,使得浓度降低;B、配制前,容量瓶中有少量蒸馏水,对配置后的浓度没有影响,因为在配制的过程中要加水的;C、NaOH溶解是放热的,溶液体积是膨胀的,未冷却就立即转移到容量瓶中,并进行定容,等冷却后体积就会减小,浓度偏大;D、往容量瓶转移时,有少量液体溅出会造成NaOH有损失,使浓度偏低;E、在容量瓶中定容时俯视容量瓶刻度线会使得配制溶液的体积偏小,浓度就偏大;F、定容摇匀后再加水会使溶液的体积偏大,导致浓度偏小,摇匀是体积发生变化那是分子间作用造成的,放置一段时间会恢复到原来的体积。故选C、E。
考点:一定物质的量浓度溶液的配制。
本题难度:一般
2、实验题 实验室用密度为1.18g/mL,质量分数为36.5%浓盐酸配制250mL0.2mol/L的盐酸溶液,填空并请回答下列问题:
(1) 配制250mL0.2mol/L的盐酸溶液
计算应称量盐酸体积/mL
| 应选用容量瓶的规格/mL
| 除量筒、容量瓶、烧杯外还需的其它仪器
|
|
|
|
(2)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次) _ __ __;
A.用30mL水洗涤烧杯2—3次,洗涤液均注入容量瓶,振荡
B.用量筒量准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入250mL的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1—2cm处
(3)操作A中,将洗涤液都移入容量瓶,其目的是 ____ ,
(4)若出现如下情况,对所配溶液浓度将有何影响(填“偏高”、“偏低”或“无影响”)?
若没有进行A操作 ;
若加蒸馏水时不慎超过了刻度 ;
若定容时俯视刻度线___________________。
(5)若实验过程中出现如下情况如何处理?
向容量瓶中转移溶液时(实验步骤②)不慎有液滴掉在容量瓶外面__________________________________________________________________________ 。
参考答案:(1)4.2,250,玻璃棒、胶头滴管。
(2)B、C、A、F、E、D
(3)保证溶质全部转入容量瓶。
(4)浓度偏低;偏低;偏高。
(5)宣告实验失败,洗净容量瓶后重新配制。
本题解析:(1)浓盐酸的物质的量浓度为:1000ρw/M=11.8mol?L?1,设量取浓盐酸的体积为V,11.8mol/L×V=0.2mol/L×0.25L,V=0.0042L=4.2mL;配制250mL0.2mol/L的盐酸溶液,所以容量瓶的规格是250mL;配制盐酸溶液所需的仪器有量筒、烧杯、玻璃棒、250mL容量瓶、胶头滴管,所以除量筒、容量瓶、烧杯外外还需要的其它仪器有玻璃棒、胶头滴管。
(2)配制步骤有量取、稀释、移液、洗涤、定容、摇匀等操作,所以配制时,其正确的操作顺序是B、C、A、F、E、D。
(3)操作A中,将洗涤液都移入容量瓶,其目的是保证溶质全部转入容量瓶,减少误差。
(4)a.没有进行A操作,导致溶质的物质的量偏小,配制溶液的浓度偏低;b.加蒸馏水时不慎超过了刻度,导致溶液的体积偏大,配制溶液的浓度偏低;c.定容时俯视偏低,导致溶液的体积偏小,配制溶液的浓度偏高。
(5)向容量瓶中转移溶液时(实验步骤②)不慎有液滴掉在容量瓶外面,导致配制溶液的浓度偏低,所以宣告实验失败,洗净容量瓶后重新配制。
考点:本题考查一定物质的量浓度溶液的配制、误差分析。
本题难度:困难
3、选择题 下列叙述正确的是(用NA代表阿伏加德罗常数的值)
A.2.4 g金属镁变为镁离子时失去的电子数为0.1NA
B.1 mol HCl气体中的粒子数与0.5 mol/L盐酸中溶质粒子数相等
C.任何条件下,16gCH4与18 g H2O所含有电子数均为10NA
D.22.4 L的CO气体与1 mol N2所含的电子数相等
参考答案:C
本题解析:A错误,2.4 g金属镁变为镁离子时失去的电子数为0.2NA
B错误,不知道盐酸溶液的体积。
C正确。
D错误,不知道一氧化碳所处的温度压强状态。
本题难度:一般
4、计算题 黄铜矿的主要成分X是由Cu、Fe、S三种元素组成的复盐,其中Cu、Fe两种元素的质量比为8:7;将m g X粉末全部溶于200 mL的浓HNO3,反应后的溶液加水稀释至2.12 L时测得其pH为0;将稀释后的溶液分为两等份,向其中一份溶液中滴加6.05 mol/L的NaOH溶液,向另一份溶液中滴加0.600 mol/L Ba(NO3)2溶液,两溶液中均生成沉淀,且沉淀的质量随所加溶液的体积变化如下图所示:
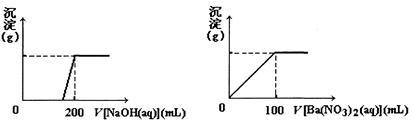
(1)请通过计算确定m的值;
(2)X的摩尔质量为368 g/mol,请确定X的化学式。
参考答案:(1)解:依题意,m?g?X中:n(Cu):n(Fe)=1:1
2n(Cu2+)+3n(Fe3+)=6.05mol/L×0.2 L×2-1 mol/L×2.12 L
故:n(Cu)=n(Fe)=0.06 mol?(2分)
又,n(S)=0.6 mol/L×0.1 L×2=0.12 mol
因此,mg=m(Cu)+m(Fe)+m(S)=0.06 mol×64 g/mol+0.06 mol×56 g/mol+0.12 mol×32 g/mol=?11.04 g
即m的值为11.04(2分)
(2)解:设X的化学式为(CuFeS2)n,则:(64+56+32×2)×n=368? n=2,故X的化学式为Cu2Fe2S4(2分)
本题解析:(1)依题意,Cu、Fe两种元素的质量比为8:7,则m?g?X中:n(Cu):n(Fe)=8/64:7/56=1:1,当加水稀释至?2.12?L时测得其pH为0,此是氢离子浓度为1mol/L,根据图示数据,氢氧化钠先中和氢离子,然后将金属离子转化为沉淀,所以2n(Cu2+)+3n(Fe3+)=6.05mol?L-1×0.2L×2-1mol?L-1×2.12L,
故:n(Cu)=n(Fe)=0.06mol,n(S)=0.600mol?L-1×0.1L×2=0.12mol,
因此mg=m(Cu)+m(Fe)+m(S)=0.06mol×64g?mol-1+0.06mol×56g?mol-1+0.12mol×32g?mol-1=11.04g,即m的值为11.04.
(2)解:设X的化学式为(CuFeS2)n,则(64+56+32×2)×n=368,解得:n=2,故X的化学式为Cu2Fe2S4.
本题难度:一般
5、填空题 (9分)(1)明矾晶体可用来净水,它的化学式为 。
(2)反应KClO3+6HCl=KCl+3Cl2↑+3H2O 中氧化剂是 氧化剂和还原剂的物质的量之比:_______。
(3)加热10.0g碳酸钠和碳酸氢钠的混合物至质量不在变化,剩余固体的质量为8.45g,则混合物中碳酸钠的质量分数为 。 (填能或者不能)用澄清石灰水鉴别碳酸钠和碳酸氢钠溶液。
参考答案:(9分)(1)KAl(SO4)2·12H2O (1分)
(2)KClO3 (2分) 1:5 (2分) (3)42% (2分) 不能(2分)
本题解析:(1)明矾属于复盐,其化学式是KAl(SO4)2·12H2O。
(2)根据反应的方程式可知,氯酸钾中氯元素的化合价从+5价降低到0价,而氯化钾中氯元素的化合价从-1价升高到0价,所以氧化剂是氯酸钾,还原剂是氯化钾,二者的物质的量之比是1:5。
(3)碳酸氢钠受热分解的化学方程式是2NaHCO3 Na2CO3+H2O+CO2↑,根据题意可知,反应中固体质量减少1.55g,所以碳酸氢钠的质量是
Na2CO3+H2O+CO2↑,根据题意可知,反应中固体质量减少1.55g,所以碳酸氢钠的质量是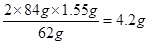 ,所以混合物中碳酸钠的质量分数为4.2÷10=42%。碳酸钠和碳酸氢钠都能和氢氧化钙反应生成白色沉淀碳酸钙,所以不能用澄清石灰水鉴别碳酸钠和碳酸氢钠溶液。
,所以混合物中碳酸钠的质量分数为4.2÷10=42%。碳酸钠和碳酸氢钠都能和氢氧化钙反应生成白色沉淀碳酸钙,所以不能用澄清石灰水鉴别碳酸钠和碳酸氢钠溶液。
考点:考查氧化还原反应的有关判断、依据碳酸氢钠分解的有关计算等
点评:如果是同一种元素的高价态和低价态之间发生氧化还原反应,则生成物的价态只能介于二者之间,且氧化产物的价态不能高于还原产物的价态,据此可以进行有关的判断。
本题难度:一般