微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列各原子或离子的电子排布式错误的是
[? ]
A.K+ 1s22s22p63s23p6
B.F 1s22s22p5
C.S2- 1s22s22p63s23p4
D.Ar 1s22s22p63s23p6
参考答案:C
本题解析:
本题难度:简单
2、简答题 (1)带有2个单位正电荷的粒子ZAX2+,其中A是137,中子数是81.那么该微粒的核电荷数是______;核外电子数是______.
(2)已知aA+,bB2+,cC-,dD2-四种离子具有相同的电子层结构,则a、b、c、d由大到小的顺序为:______.
参考答案:(1)质量数=质子数+中子数,所以该微粒的核电荷数=质子数=137-81=56,核外电子数=56-2=54,故答案为:56;54;
(2)阳离子的核外电子数=质子数-所带的电荷数,阳离子的核外电子数=质子数+所带的电荷数,离子具有相同的电子层结构说明核外电子数相等,
所以a-1=b-2=c+1=d+2,则a、b、c、d由大到小的顺序为b>a>c>d.
故答案为:b>a>c>d.
本题解析:
本题难度:一般
3、简答题 已知:A-F都是周期表中前四周期的元素,它们的原子序数依次增大.其中A、C原子的L层有2个未成对电子.D与E同主族,D的二价阳离子与C的阴离子具有相同的电子层结构.F3+离子的M层3d轨道电子为半充满状态.请根据以上信息,回答下列问题:(答题时,用所对应的元素符号表示)
(1)A、B、C的电负性由小到大的顺序为______.
(2)D元素的原子核外共有______种不同运动状态的电子、______种不同能级的电子.
(3)H2S和C元素的氢化物(分子式为H2C2)的主要物理性质比较如下:
| 熔点 | 沸点 | 标准状况时在水中的溶解度
H2S
187
202
2.6
H2C2
272
423
以任意比互溶
|
H2S和H2C2的相对分子质量基本相同,造成上述物理性质差异的主要原因是______.AC2中心原子的杂化方式为______,某离子与AC2互为等电子体,且能用于鉴别F3+,写出该离子的电子式______.
(4)写出E的电子排布式:______.
(5)F和X(质子数为25)两元素的部分电离能数据列于表:
| 元素 | X | F
|
电离能kJ?mol-1
I1
717
759
I2
1509
1561
I3
3248
2957
|
比较两元素的I2、I3可知,气态X2+再失去一个电子比气态F2+再失去一个电子难.对此,你的解释是______.
参考答案:A、B、C、D、E、F都是周期表中前四周期的元素,它们的原子序数依次增大.A、C原子的L层有2个未成对电子,为碳元素和氧元素,原子序数A<C,所以A为C元素,C为O元素;
B的原子序数介于A与C之间,所以B为N元素;
D的二价阳离子与C的阴离子具有相同的电子层结构,D为Mg元素,D与E同主族,原子序数D<E,则E为Ca元素;
F3+离子M层3d轨道电子为半满状态,则F为Fe元素;
即A为C元素,B为N元素,C为O元素,D为Mg元素,E为Ca元素,F为Fe元素;
(1)A为C元素,B为N元素,C为O元素,同一周期元素,元素的电负性随着原子序数的增大而增大,所以电负性大小顺序是C<N<O,
故答案为:C<N<O;
(2)D为Mg元素,原子中电子的运动状态种类与其电子数相等,所以镁原子核外有12种不同运动状态的电子,有1s、2s、2p、3s四种不同能级的电子,
故答案为:12;4;
(3)C为O元素,非金属性较强,对应的氢化物能形成氢键,且与水分子之间也可以形成氢键,所以H2O2的沸点比H2S高;
CO2中心原子价层电子对个数是2,所以中心原子的杂化方式为sp,某离子与CO2互为等电子体,且能用于鉴别Fe3+的离子为SCN-,该离子的电子式为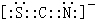 ,
,
故答案为:H2O2分子间存在氢键,与水分子可形成氢键;sp;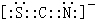 ;
;
(4)E为Ca元素,钙原子核外有20个电子,根据构造原理知,其核外电子排布式为1s22s22p63s23p64s2,
故答案为:1s22s22p63s23p64s2;
(5)质子数为25的元素为Mn,由于Mn2+的3d轨道电子排布为半满状态较稳定,难以失去电子,
故答案为:Mn2+的3d轨道电子排布为半满状态较稳定.
本题解析:
本题难度:一般
4、选择题 含有非极性键且分子中各原子都满足8电子稳定结构的是( )
A.CH4
B.CO2
C.BeCl2
D.N2
参考答案:D
本题解析:
本题难度:简单
5、填空题 已知x、y是原子,核电荷数不大于18,x原子的最外层电子数为n个,次外层电子数为n+2个,y原子的最外层电子数为m-5个,次外层为m个,推断x和y两元素可能是______.
参考答案:x原子的最外层电子数为n个,次外层电子数为n+2个,核电荷数不大于18,n满足下列条件:0<n≤8且n+2=2或8,得n=6,故x是S元素;y原子的最外层电子数为m-5个,次外层为m个,核电荷数不大于18,m满足下列条件:0<m-5≤8,且m=2或8,得m=8,故y是Al元素.
故答案为:S;Al
本题解析:
本题难度:一般