微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 A、J是日常生活中常见的两种金属,这两种金属和NaOH溶液组成原电池,A作负极;F常温下是气体,各物质有以下的转化关系(部分产物及条件略去)。回答以下问题:
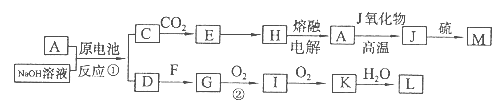
(1)A的原子结构示意图为?,M的化学式为??。
(2)A与NaOH溶液反应的离子方程式为?。
(3)写出②的化学方程式?。
(4)含A元素的某盐X常做净水剂,X做焰色反应时,透过蓝色钴玻璃观察火焰呈紫色。X的水溶液与NaHCO3溶液混合,反应的离子方程式为?。
参考答案:(1) ,FeS;(2)2Al + 2OH- + 6H2O=2[Al(OH)4]- + 3H2↑;(3)4NH3+5O2
,FeS;(2)2Al + 2OH- + 6H2O=2[Al(OH)4]- + 3H2↑;(3)4NH3+5O2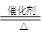 4NO+6H2O;(4)Al3+ + 3HCO3-= Al(OH)3↓ + 3CO2↑。
4NO+6H2O;(4)Al3+ + 3HCO3-= Al(OH)3↓ + 3CO2↑。
本题解析:根据题意知,A、J是日常生活中常见的两种金属,这两种金属和NaOH溶液组成原电池,A作负极,则A为铝;结合流程图知,C为偏铝酸钠,E为氢氧化铝,H为氧化铝,J为铁,M为硫化亚铁,D为氢气,F为氮气,G为氨气,I为一氧化氮,K为二氧化氮,L为硝酸。(1)A为铝,原子结构示意图为 ,M为硫化亚铁,化学式为FeS;(2)铝与NaOH溶液反应生成四羟基合铝酸钠和氢气,离子方程式为2Al + 2OH- + 6H2O==2[Al(OH)4]- + 3H2↑;(3)反应②为氨的催化氧化,化学方程式4NH3+5O2
,M为硫化亚铁,化学式为FeS;(2)铝与NaOH溶液反应生成四羟基合铝酸钠和氢气,离子方程式为2Al + 2OH- + 6H2O==2[Al(OH)4]- + 3H2↑;(3)反应②为氨的催化氧化,化学方程式4NH3+5O2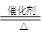 4NO+6H2O;(4)含A元素的某盐X常做净水剂,X做焰色反应时,透过蓝色钴玻璃观察火焰呈紫色。X为明矾,其水溶液与NaHCO3溶液混合,反应的离子方程式为
4NO+6H2O;(4)含A元素的某盐X常做净水剂,X做焰色反应时,透过蓝色钴玻璃观察火焰呈紫色。X为明矾,其水溶液与NaHCO3溶液混合,反应的离子方程式为
Al3+ + 3HCO3-="=" Al(OH)3↓ + 3CO2↑。
本题难度:一般
2、填空题 (12分)X、Y、Z、L、M五种元素的原子序数依次增大。X、Y、Z、L是组成蛋白质的基础元素,M是地壳中含量最高的金属元素。回答下列问题:
(1) L的轨道表示式为________;
(2)五种元素的原子半径从大到小的顺序是____________________(用元素符号表示)。
(3)Z、X两元素按原子数目比l∶3和2∶4构成分子A和B,A的分子空间构型为____________,A的电子式为____________,B的结构式为____________。
(4) 硒(se)是人体必需的微量元素,与L同一主族,Se原子比L原子多两个电子层。该族2-- 5周期元素单质分别与H2反应生成l mol气态氢化物的反应热如下,表示生成1 mol硒化氢反应热的是__________(填字母代号)。
a.+99.7 kJ·mol-1? b.+29.7 kJ·mol-1
c.-20.6 kJ·mol-1? d.-241.8 kJ·mol-1
(5)工业上常用电解M2L3的方法来制取M单质。当制得54克M单质时,转移电子的物质的量是___________ mol
参考答案:(12分)(1)O的轨道表示式:略(2分)
(2) Al>C>N>O>H(2分)
(3) 三角锥型(1分)?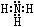 ?(1分)
?(1分) (2分)
(2分)
(4) b(2分)
(5) 6 mol(2分)
本题解析:略
本题难度:简单
3、填空题 物质A、B、C、D、E、F、G、H、I、J、K有下图转化关系,其中气体D、E为单质,

请按要求回答下列问题。
⑴组成金属A的元素在周期表的位置是_____________,
D的化学式是__________________
⑵写出反应“C→F”的离子方程式?;
⑶写出反应“ I→J”的离子方程式?;
⑷写出金属 H与水蒸气在高温下反应的化学方程式?。
参考答案:(1)第三周期ⅢA族、 HCl
(2)Al3++3NH3·H2O=Al(OH)3+3NH4+
(3)2Fe2++Cl2=2Fe3++2Cl-
(4)3Fe+4H2O=Fe3O4+4H2
本题解析:本题无机框图题,关键是找准突破点。红褐色沉淀K,所以K是氢氧化铁。黄绿色气体E,说明E是氯气,则B是氯化氢,H是铁,I是氯化亚铁,J是氯化铁。A是铝,C是氯化铝,F是氢氧化铝,G是偏铝酸钠。
本题难度:一般
4、简答题 由短周期元素组成的物质A-K,它们之间具有下图的转化关系:(图中反应条件已省略)已知:A是常见金属;B是常见非金属单质,常温为固体,其颜色常呈黑色或无色;E、F为常见气体,混合时点燃发生爆炸.
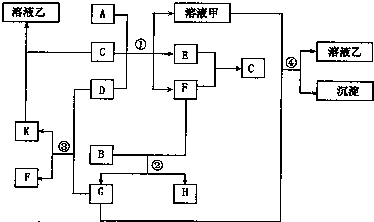
(1)写出:构成物质A的原子结构示意图:______;D的电子式:______;K的俗名:______;
(2)写出反应①各物质恰好完全反应的化学方程式:______;
(3)反应②中,若B和F按物质的量之比为4:3恰好完全反应,则生成物物质的量之比n(G):n(H)______.
参考答案:B是常见非金属单质,常温为固体,其颜色常呈黑色或无色;E、F为常见气体,混合时点燃发生爆炸,应为O2和H2的反应,则C为H2O,A是常见金属,与另一种固体在水中反应生成O2和H2,则该固体金属为Al,固体D为Na2O2,能与水和CO2反应,则G为CO2;再依据K能溶于水,说明K为Na2CO3,F为O2; 题给信息黑色单质B与氧气(F)反应得到G(CO2),说明B为C(碳),C和氧气反应可生成CO2和CO,则H为CO;依据F(O2)与E反应生成C(水)可知E为氢气,
则A为Al,B为C,C为H2O,D为Na2O2,E为H2,F为O2,G为CO2,H为CO,K为Na2CO3,
(1)A为Al,原子核外有3个电子层,最外层电子数为3,原子结构示意图为
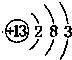
,D为Na2O2,为离子化合物,电子式为
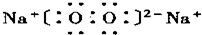
,K为Na2CO3,俗称纯碱,
故答案为:
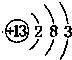
;
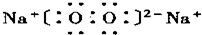
;纯碱;
(2)反应①为Al和Na2O2在水的反应,当恰好完全反应式,生成NaAlO2,
反应的方程式为2Na2O2+4Al+6H2O═4NaAlO2+6H2↑+O2,
故答案为:2Na2O2+4Al+6H2O═4NaAlO2+6H2↑+O2;
(3)B为C,F为O2,按物质的量之比为4:3恰好完全反应,反应的化学方程式为,4C+3O2?点燃?.?2CO2+2CO,生成物物质的量之比n(G):n(H)=1:1,
故答案为:1:1.
本题解析:
本题难度:一般
5、推断题 如图A~J均代表无机物或其水溶液,其中B、D、G是单质,B是地壳中含量最高的金属元素,G是气体,J是磁性材料,常温下H为无色液体。
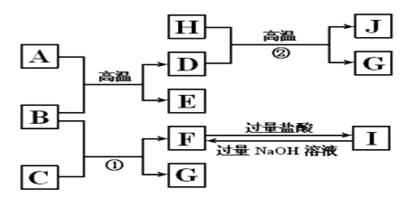
根据图示回答问题:
(1)写出下列物质的化学式:B________,E________,I________;
(2)写出反应A+B→E+D的一种用途__________________;
(3)反应①的离子方程式是_________________________________________;
反应②的化学方程式是__________________________________________;
(4)J与盐酸反应的化学方程式是__________________?_________________;
反应后的溶液与D反应的离子方程式是___________________________________。
参考答案:共16分
(1) Al Al2O3 AlCl3(每空2分共6分)
(2) (1)焊接钢轨(或其他合理答案)?(2分)
(3)2Al+2OH-+2H2O===2AlO2—+3H2↑?(2分)
3Fe+4H2O(g)  ?Fe3O4+4H2?(2分)
?Fe3O4+4H2?(2分)
(4)Fe3O4+8HCl===FeCl2+2FeCl3+4H2O?(2分)
2Fe3++Fe===3Fe2+?(2分)
本题解析: B是地壳中含量最高的金属元素,B是Al,J是磁性材料Fe3O4,D是单质,D是Fe,H为无色液体,H是H2O, G是单质,G是H2,A是Fe2O3,E是Al2O3,C是NaOH,F是NaAlO2,I是AlCl3。
(1) B是Al,E是Al2O3,I是AlCl3。
(2)铝置换铁,故用途是焊接钢轨。
(3) 反应①是Al和NaOH反应生成H2,离子方程式是2Al+2OH-+2H2O===2AlO2—+3H2↑。反应②Fe和水蒸气的反应,方程式是3Fe+4H2O(g)  ?Fe3O4+4H2。
?Fe3O4+4H2。
(4) J是 Fe3O4与盐酸的反应方程式是Fe3O4+8HCl===FeCl2+2FeCl3+4H2O。
Fe能还原Fe3+,故离子方程式是2Fe3++Fe===3Fe2+。
点评:此题为框图式物质推断题,完成此类题目,关键是找准解题突破口,直接得出结论,然后利用顺向或逆向或两边向中间推,逐一导出其他结论。
本题难度:一般