微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd+2NiO(OH)+2H2O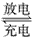 Cd(OH)2+2Ni(OH)2。有关该电池的说法正确的是
Cd(OH)2+2Ni(OH)2。有关该电池的说法正确的是
[? ]
A.充电时阳极反应:Ni(OH)2-e-+OH-=NiO(OH)+H2O
B.充电过程是化学能转化为电能的过程
C.放电时负极附近溶液的碱性不变
D.放电时电解质溶液中的OH-向正极移动
参考答案:A
本题解析:
本题难度:一般
2、选择题 如图所示,电解未精制饱和食盐水(含有少量Mg2+),在碳棒和铁片表面均有气体生成,一段时间后铁片附近出现浑浊现象。下列叙述正确的是
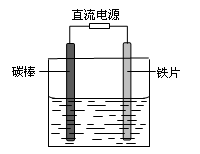
A.碳棒接直流电源的负极
B.碳棒上发生氧化反应
C.铁片上的电极反应式为2Cl――2e-= Cl2↑
D.铁片附近出现的浑浊物是Mg(OH)2
参考答案:BD
本题解析:如果铁片接电源正极,则会失电子溶解,不可能产生气体,故铁片连接电源负极,碳棒连接电源正极;
碳棒阳极:2Cl――2e-= Cl2↑
铁片阴极:2H++2e-=H2↑,破坏了水的电离平衡,使溶液呈碱性,有Mg(OH)2生成上:Mg2++2OH-=Mg(OH)2↓
答案为BD
本题难度:一般
3、选择题 下列叙述正确的是( )
A.不溶性盐都是弱电解质,可溶性酸都是强电解质
B.强酸溶液中的氢离子浓度一定大于弱酸溶液中的氢离子浓度
C.二氧化硫和乙醇均属共价化合物,是非电解质
D.NaOH溶液的导电性一定比氨水溶液的导电性强
参考答案:C
本题解析:略
本题难度:简单
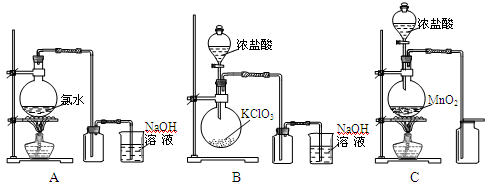
4、实验题 (17分)氯气在工农业生产中应用非常广泛。请回答以下问题:
(1)下面是三位同学分别设计的实验室制取和收集氯气的装置,其中最好的是 (填序号):
(2)某课外小组同学用如图所示装置通过电解食盐水并探究氯气相关性质,请回答:
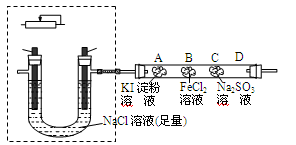
①现有电极:C和Fe供选择,请在虚框中补画导线、电源( ),串联变阻器以调节电流,同时标出电极材料;电解的离子反应方程式为 。
),串联变阻器以调节电流,同时标出电极材料;电解的离子反应方程式为 。
②通电一段时间后,玻璃管A、B、C三处是浸有不同溶液的棉花,其中A、B两处的颜色变化分别为 、 ;C处发生的离子反应方程式为 。
③为防止氯气逸出造成污染,应采取的措施是 。
(3)当在阴极收集到气体448mL(标准状况)后停止实验,将U形管溶液倒于量筒中测得体积为400mL,则摇匀后理论上计算得溶液pH= 。
参考答案:(1)(2分)B
(2)①见右图: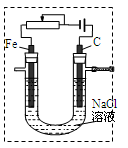 (2分) 2Cl-+2H2O====Cl2↑+H2↑+2OH-(3分)
(2分) 2Cl-+2H2O====Cl2↑+H2↑+2OH-(3分)
②无色变蓝色(2分)、浅绿色变黄色(2分)
Cl2+SO32-+H2O==2Cl-+ SO42-+2H+(2分)
③在D处放一团浸有NaOH溶液的棉花(或将尾气通入盛有NaOH溶液的烧杯中。2分)
(3)(2分)13
本题解析:(1)氯气在水中的溶解度不大,A装置用加热氯水的方法制氯气得到的氯气较少;氯气有毒,应进行尾气处理,装置C缺少尾气处理装置;实验室制取和收集氯气的装置最好的是B;(2)①通过电解食盐水制备氯气并探究氯气相关性质,氯气为阳极产物,产生氯气的电极应与电源的正极相连,装置图见答案;电解的离子反应方程式为2Cl-+2H2O Cl2↑+H2↑+2OH-;②通电一段时间后,玻璃管A处氯气与碘化钾反应生成单质碘,碘遇淀粉变蓝色;B处氯气与氯化亚铁反应生成氯化铁,由浅绿色变黄色;C处氯气与亚硫酸钠溶液反应生成硫酸钠和盐酸,发生的离子反应方程式为Cl2+SO32-+H2O==2Cl-+ SO42-+2H+;③为防止氯气逸出造成污染,应采取的措施是在D处放一团浸有NaOH溶液的棉花(或将尾气通入盛有NaOH溶液的烧杯中);(3)阴极收集到的气体为H20.448L,n(H2)=0.448L÷22.4L/mol=0.02mol;由方程式:2Cl-+2H2O
Cl2↑+H2↑+2OH-;②通电一段时间后,玻璃管A处氯气与碘化钾反应生成单质碘,碘遇淀粉变蓝色;B处氯气与氯化亚铁反应生成氯化铁,由浅绿色变黄色;C处氯气与亚硫酸钠溶液反应生成硫酸钠和盐酸,发生的离子反应方程式为Cl2+SO32-+H2O==2Cl-+ SO42-+2H+;③为防止氯气逸出造成污染,应采取的措施是在D处放一团浸有NaOH溶液的棉花(或将尾气通入盛有NaOH溶液的烧杯中);(3)阴极收集到的气体为H20.448L,n(H2)=0.448L÷22.4L/mol=0.02mol;由方程式:2Cl-+2H2O Cl2↑+H2↑+2OH- 得:
Cl2↑+H2↑+2OH- 得:
n(OH-)=0.02mol×2=0.04mol;c(OH-)="0.04mol÷0.4L=0.1mol/L" 则pH=14-(-lg10-1)=13。
考点:考查氯气的制备和性质,电解原理的应用。
本题难度:困难
5、选择题 若阴、阳两极分别为碳和铁,电解NaOH溶液时,当生成10.7g?Fe(OH)3沉淀时,共消耗a?molH2O,产生b?LH2(标准状况).则a和b分别为( )
A.a=0.25,b=4.48
B.a=0.3,b=3.36
C.a=0.25,b=2.24
D.a=0.2,b=22.24
参考答案:电极反应分别为:阳极:Fe→Fe2++2e-,阴极:2H++2e-→H2↑,总的反应为:Fe+2H2O?通电?.?Fe(OH)2+H2↑,
4Fe(OH)2+O2+2H2O═4Fe(OH)3,根据方程式得到:当生成0.1mol?Fe(OH)3沉淀时,共消耗H2O=0.2mol+0.05mol=0.025mol,产生0.1molH2,即标准状况下2.24L氢气.
故选C.
本题解析:
本题难度:简单