微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 联碱法(候氏制碱法)和氨碱法的生产流程简要表示如下图:
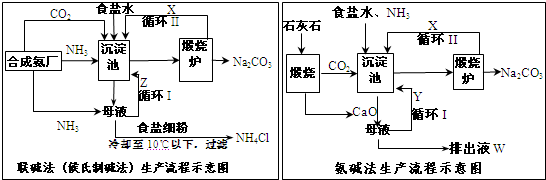
(1)X是______,Y是______(填化学式);______.
(2)Z中除了溶解的氨气、食盐外,其它溶质还有Na2CO3、______(写化学式);排出液中的溶质除了氢氧化钙外,还有CaCl2、______.
(3)从理论上分析,在氨碱法生产过程中______(填“需要”、“不需要”)补充氨气,对比于氨碱法,指出“联碱法”的一项优点______.
(4)由“联碱法”从母液中提取氯化铵晶体的过程推测,以下结论正确是______
a.常温时氯化铵的溶解度比氯化钠小;?b.通入氨气目的是使氯化铵更多析出;
c.加入食盐细粉目的是提高Na+的浓度,促进碳酸氢钠结晶析出.
(5)取联碱法生产的纯碱样品(设其中的杂质不与盐酸反应)11.0g配成250.0mL溶液,取25.0mL溶液用1.00mol/L的标准盐酸滴定,消耗盐酸20.0mL.请计算纯碱样品的纯度,写出计算过程.
参考答案:(1)依据联碱法和氨碱法生成流程图分析判断沉淀池中的反应是氨气、二氧化碳、饱和食盐水反应生成溶解度晓得碳酸氢钠晶体;联碱法煅烧炉中是加热碳酸氢钠分解,则X为二氧化碳;氨碱法是母液中加入氧化钙反应生成氨气循环使用;所以Y为氨气;沉淀池中发生反应的化学方程式为NH3 NaCl+NH3+CO2+H2O═NaHCO3↓+NH4Cl,
故答案为:CO2;NH3 NaCl+NH3+CO2+H2O═NaHCO3↓+NH4Cl;
(2)依据联碱法发生的反应,生成产物中得到母液主要是氯化铵;氨碱法的流程中排除液主要是氢氧化钙和氯化铵、碳酸氢钠反应生成的氯化钠、氯化钙;
故答案为:NH4Cl(或NH4HCO3);NaCl;
(3)流程分析氨碱法反应生成的铵盐和加入的氧化钙反应生成氨气循环使用,不需要补充氨气;从 两个过程需要的原理和循环利用分析氨价法循环利用氨气时加入的氧化钙在反应过程中 会最终生成无用的氯化钙,联碱法反应过程中最终生成氯化铵可以做氮肥;
故答案为:不需要;不产生无用的CaCl2(或提高了食盐的转化率,或原料利用率高等;
(4)a温时氯化铵的溶解度比氯化钠大,故a错误;
b通入氨气铵根离子浓度增大促使氯化铵析出晶体,所以目的是使氯化铵更多析出,故b正确;
c加入食盐细粉目的是提高Cl-的浓度,促进氯化铵结晶析出;故c错误;
故选b.
(5)25.0mL纯碱液中含有Na2CO3的质量为xg.
则:Na2CO3+2HCl═2NaCl+CO2↑+H2O
? ? 106g?2mol
? x?1.00mol/L×20.0mL?
x=1.06g×1.00mol/L×20.0ml2mol=1.06g;
则样品纯度为:1.06g×250mL25.0mL11.0g×100%=96.4%
故答案为:96.4%
本题解析:
本题难度:一般
2、选择题 “NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl”是“侯氏制碱法”的重要反应.下面是4位同学对该反应涉及的有关知识发表的部分见解.其中不正确的是( )
A.
B.
C.
D.
参考答案:C
本题解析:
本题难度:一般
3、选择题 我国著名的化工专家侯德榜在20世纪20年代所创立的“侯氏制碱法”誉满全球.“侯氏制碱法”中的碱是指下列的( )
A.NaOH
B.K2CO3
C.Na2CO3
D.NaHCO3
参考答案:C
本题解析:
本题难度:一般
4、简答题 我国化学家侯德榜改革国外的Na2CO3生产工艺,创造了侯氏制碱法,又叫联邦制碱法,该法是将合成氨工厂生产的NH3及副产品
CO2,通入到饱和食盐水中得到NaHCO3,分离出的NaHCO3加热制得Na2CO3.某研究性学习小组设计如图所示的模拟装置,该装置可实现部分原料的循环使用.
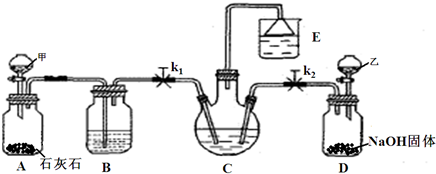
(1)分液漏斗甲中为盐酸,装置B中试剂为______,分液漏斗乙中是易挥发的某试剂,该试剂为______.
(2)实验操作过程中,应先打开______(填“k1”或“k2”),当观察到______现象时,再打开另一个弹簧夹.
(3)装置E中试剂为饱和NaCl溶液,该装置能体现绿色化学思想的两个作用是______、______.
(4)老师认为在C、D之间还应增加一个装置,该装置作用为______.
(5)写出C中生成NaHCO3的化学方程式______.
参考答案:(1)分液漏斗甲中为盐酸,滴入A中和石灰石反应生成二氧化碳气体,气体中含有氯化氢气体,装置B中试剂为饱和NaHCO3溶液,依据候氏制碱原理可知D装置是制备氨气的装置,结合液体滴入固体氢氧化钠产生氨气实验判断,乙分液漏斗中为浓氨水滴入后会生成氨气通入C装置反应;分液漏斗乙中是易挥发的某试剂,该试剂为浓氨水;
故答案为:饱和NaHCO3溶液;浓氨水
(2)候氏制碱方法是利用氨气溶解性大极易溶解于水,二氧化碳气体水中溶解性较小,实验饱和食盐水中先通入氨气,再通入二氧化碳气体;实验操作过程中,应先打开k2,观察到E中漏斗有液面上升时,再打开另一个弹簧夹K1.故答案为:k2,观察到E中漏斗有液面上升时;
(3)装置E中试剂为饱和NaCl溶液,该装置能体现绿色化学思想的两个作用是:吸收氨气防止污染;获得NaCl和氨水的饱和液循环使用;
故答案为:吸收氨气防止污染;获得NaCl和氨水的饱和液循环使用;
(4)氨气极易溶于水直接通入食盐水会发生倒吸,实验CD间应加一个放倒吸的装置,故答案为:防止倒吸;
(5)C中生成NaHCO3的化学方程式:NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl;故答案为:NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl;
本题解析:
本题难度:一般
5、填空题 纯碱是一种重要的化工原料。目前制碱工业主要有“氨碱法”和“联合制 碱法”两种工艺。请按要求回答问题:
?(1)“氨碱法”产生大量CaCl2废弃物,请写出该工艺中产生CaCl2的化学方程式:_______________________________________________________;
(2)写出“联合制碱法”有关反应的化学方程式:____________________________________________;
(3) CO2是制碱工业的重要原料,“联合制碱法”与“氨碱法”中CO2的来源有何不同?__________________________________________________________;
(4)绿色化学的重要原则之一是提高反应的原子利用率。根据“联合制碱法”总反应,列出计算原子利用率的表达式:
原子利用率(%) =________________________________。
参考答案:
(1)2NH4Cl+Ca( OH)2===2NH3↑+CaCl2+ 2H2O?
(2)NH3+CO2 +H2O +NaCl(饱和)=== NaHCO3↓+NH4Cl? 2NaHCO3===Na2CO3 +CO2↑+H2O (或写总反应方程式:2NaCl+2NH3 +CO2 +H2O===Na2CO3+ 2NH4C1)
(3)“氨碱法”中的CO2来源于石灰石煅烧,“联合制碱法”中的CO2来源于合成氨工业的废气;
(4)“联合制碱法”原子利用率的表达式:

本题解析:
本题难度:一般