微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 已知NaHCO3低温时溶解度小,侯德榜制碱的方法是:向氨化的饱和食盐水中通入过量的二氧化碳,即有晶体析出,经过滤、洗涤、焙烧得纯碱.此过程可以表示为:
①NaCl?(饱和)+NH3+CO2+H2O=NaHCO3↓+NH4Cl(此反应是放热反应)
②2NaHCO3
Na2CO3+CO2↑+H2O
现某化学小组根据上述原理在实验室中模拟制碱过程,下图C装置是溶有氨和NaCl的溶液,且二者均达到了饱和.
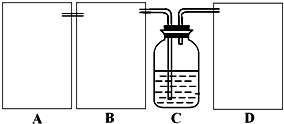
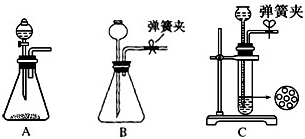
(1)制CO2时为了使反应随开随用,随关随停,上图A方框内应选用以下______装置.简述该装置随关随停的理由______.
(2)为使实验能够进行,在B、D方框内补上所需装置,并指明所用试剂(将装置图画在答题纸上)
(3)完成第(2)步,该小组检验气密性合格后进行实验,发现析出的晶体非常少,在老师的指导下,他们对某个装置进行了改进,达到了实验目的.你认为他们的改进方法是______.
(4)若所用饱和食盐水中含有NaCl的质量为5.85g,实验后得到干燥的NaHCO3晶体的质量为5.46g,假设第二步分解时没有损失,则Na2CO3的产率为______.
参考答案:(1)启普发生器是随时进行,随时停止的装置,适用于固体和液体不加热反应生成不溶于水的气体制备反应,所以制CO2时为了使反应随开随用,随关随停应符合启普发生器的原理应用,利用止水夹控制气体压强,使液体和固体分离停止反应,打开压强减小液体和固体接触继续反应;
故答案为:C,关闭弹簧夹后反应生成的气体上部压强增大,到达一定程度后可把反应液压回漏斗,使固液分离从而停止反应;
(2)制备装置中C为氨化的饱和氯化钠溶液,制备出二氧化碳气体中含有氯化氢气体,影响碳酸氢钠的生成,B装置中需要通过饱和碳酸氢钠溶液除去;D装置是防止氨气污染环境,需要吸收氨气的试剂,可以是稀硫酸或水;B装置洗气装置,导气管长进短出;D装置是吸收易溶于水的氨气,同时防倒吸的装置;装置为
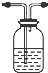
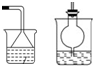
故答案为:试剂:饱和的碳酸氢钠溶液?试剂:稀硫酸或水

?

(3)通过降低温度,减小碳酸氢钠的溶解度,使碳酸氢钠析出,所以将C装置浸泡在一个盛有冰水混合物的水槽里(大烧杯)可以达到目的;
故答案为:将C装置浸泡在一个盛有冰水混合物的水槽里(大烧杯)
(4)若所用饱和食盐水中含有NaCl的质量为5.85g,理论上依据化学方程式计算:NH3+CO2+H2O+NaCl=NaHCO3+NH4Cl;得到碳酸氢钠质量为8.4g,分解生成碳酸钠质量依据化学方程式计算:2NaHCO3=Na2CO3+H2O+CO2↑;碳酸钠的质量为5.5g;实验后得到干燥的NaHCO3晶体的质量为5.46g,生成碳酸钠质量为:
2NaHCO3=Na2CO3+H2O+CO2↑;
168? 106
5.46g? 3.445g
假设第二步分解时没有损失,则碳酸钠的产率=3.445g5.3g×100%=65%;
故答案为:65%
本题解析:
本题难度:一般
2、填空题 在动物饲料中添加三聚氰胺,将提高饲料中的氮含量,让人误以为该饲料的蛋白质比较丰富,其营养价值实际上却没有增加关于三聚氰胺的合成,目前较多采用尿素法,因为此法成本低。尿素以氨气为载体,硅胶为催化剂,在380-400℃温度下沸腾反应,先分解生成氰酸(HCNO),并进一步缩合生成三聚氰胺生成的三聚氰胺气体经冷却捕集后得粗品,然后经溶解,除去杂质,重结晶得成品。下图是简单流程图,已知a、b为气体,且a极易溶于水,回答下列问题:
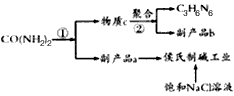
(1)反应①的化学方程式为_____________________;
(2)物质b为_____________________,反应②的化学方程式为____________________________;
(3)相同状态下,产生的气体a和b的体积之比为________________________________;
(4)我国著名化学家候德榜先生发明的“侯氏制碱法”,因原料利用率高,并能进行连续生产,从而享誉中外。本实验具体操作过程中,应先通________________气体,再通_____________________气体;某同学进行了侯氏制碱的模拟实验,实验所用的饱和NaCl溶液中含溶质58.5 g,实验最后得到无水碳酸钠26.0g,则其产率为____________;该同学针对其实验结果,认真分析了造成损失的原因,发现其操作步骤并没有错误,则主要原因是___________________________________。
参考答案:(1)CO(NH2)2 HNCO+NH3↑
HNCO+NH3↑
(2)CO2;6HNCO→C3H6N6+3CO2↑
(3)2:1
(4)NH3;CO2;49.1%;NaHCO3在水中有较大的溶解度,未能全部沉淀出来
本题解析:
本题难度:一般
3、简答题 我国化学侯德榜(右图)改革国外的纯碱生产工艺,生产流程可简要表示如下:
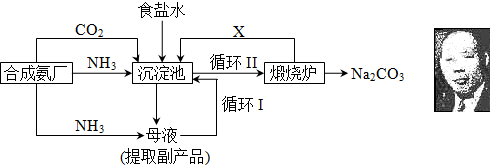
(1)上述生产纯碱的方法称______,副产品的一种用途为______.
(2)沉淀池中发生的化学反应方程式是______.
(3)写出上述流程中X物质的分子式______.
(4)使原料氯化钠的利用率从70%提高到90%以上,主要是设计了______(填上述流程中的编号)的循环.从沉淀池中取出沉淀的操作是______.
(5)为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水后,再滴加______.
(6)向母液中通氨气,加入细小食盐颗粒,冷却析出副产品,通氨气的作用有______.
(a)?增大NH4+的浓度,使NH4Cl更多地析出(b)?使NaHCO3更多地析出
(c)?使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度.
参考答案:(1)目前工业制碱方法有二:氨碱法和联合制碱法.题中方法由我们侯德邦所创,称为侯氏制碱法,也称为联合制碱法,反应方程式为NH3+H2O+CO2+NaCl→NH4Cl+NaHCO3↓,得到一摩尔的碳酸氢钠同时得到一摩尔的氯化铵,故副产物为氯化铵,氯化铵可用来制作化肥,
故答案为:联合制碱法,做化肥;
(2)沉淀池中发生的化学反应为饱和食盐水中通入氨气和二氧化碳析出碳酸氢钠晶体,反应方程式为NH3+H2O+CO2+NaCl→NH4Cl+NaHCO3↓,
故答案为:NH3+H2O+CO2+NaCl→NH4Cl+NaHCO3↓;
(3)在联合制碱法中二氧化碳是反应的原料同时也是反应的副产物,可以循环利用,
故答案为:CO2;
(4)循环Ⅰ是将未反应的氯化钠返回沉淀池中,从固液混合物中分离出固体的方法为过滤.
故答案为:循环Ⅰ,过滤;
(5)检验产品碳酸钠中是否含有氯化钠即检验是否含氯离子,可以用硝酸酸化的硝酸银,观察到若产生白色沉淀则说明有氯化钠存在,
故答案为:用硝酸酸化的硝酸银,观察产生白色沉淀;?
(6)向母液中通氨气作用有增大NH4+的浓度,使NH4Cl更多地析出和使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度.
故答案为:ac.
本题解析:
本题难度:一般
4、选择题 “NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl”是“侯氏制碱法”的重要反应.下面是4位同学对该反应涉及的有关知识发表的部分见解.其中不正确的是( )
A.
B.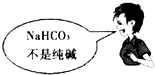
C.
D.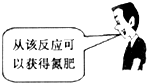
参考答案:C
本题解析:
本题难度:一般
5、简答题 纯碱在日常生活和化学工业中用途很广,如用于硬水软化、洗涤剂生产、食品加工、石油精炼、粗盐精制、玻璃制造等领域.工业上以食盐、氨气(主要由合成氨厂提供)和二氧化碳为主要原料生产纯碱.其流程如下:根据以上信息回答下列问题.
(1)盐水精制的过程是除去溶液中各种杂质的过程.为将盐水中含有的Ca2+、Mg2+等沉淀,可以向其中加入过量纯碱.此时将混合液中不溶物除去的方法是______;溶液中多余的纯碱可以加______试剂来除去.
(2)上述工艺流程中,加压条件下通入二氧化碳进行碳酸化时没有析出碳酸钠晶体,其原因是______.
(3)在氨碱工业的历史上,如何处理流程中剩余的滤液,出现了两种工艺:一是“索尔维法”,即在滤液中加入石灰水;二是我国化学家侯德榜发明的“联合制碱法”,即在滤液中加入适量氯化钠晶体.
①“索尔维法”中,滤液加石灰水前先要加热,原因是______.
②“联合制碱法”中,可以循环利用的物质是______?(用化学式表示).
(4)若采用上述流程生产106吨纯碱,则理论上通入的二氧化碳的体积(标准状况下)不得少于______L(不考虑二氧化碳的回收利用).

参考答案:(1)盐水精制的过程是除去溶液中各种杂质的过程.为将盐水中含有的Ca2+、Mg2+等沉淀,可以向其中加入过量纯碱.此时将混合液中不溶物除去的方法是过滤,在滤液中加入盐酸到不再产生气体为止除去碳酸钠;
故答案为:过滤?盐酸;
(2)述工艺流程中,加压条件下通入二氧化碳进行碳酸化时没有析出碳酸钠晶体,是因为碳酸钠溶解度比碳酸氢钠大,所以不析出碳酸钠晶体;
故答案为:碳酸钠溶解度比碳酸氢钠大;
(3)①依据生产流程的过程分析,“索尔维法”中,滤液加石灰水前先要加热,由于滤液中还含有一定量的碳酸氢钠,加热时,碳酸氢根和铵根发生双水解反应,碳酸氢根转化为CO2而除去,防止加入石灰水时产生碳酸钙沉淀,故答案为:防止加入石灰水时产生碳酸钙沉淀;
②氯化钠溶液和氯化铵溶液中都含氯离子,氯化钠是制纯碱的原料,可以循环利用的 物质为氯化钠,故答案为:NaCl;
(4)若采用上述流程生产106吨纯碱,则理论上通入的二氧化碳的体积(标准状况下)不考虑二氧化碳的回收利用,可以根据化学方程式计算得到:
NH3+H2O+CO2+NaCl=NaHCO3↓+NH4Cl;2NaHCO3=Na2CO3+CO2↑+H2O;分析得到计算关系为:
2CO2~2NaHCO3~Na2CO3;
88? 106
88吨? 106吨
所以二氧化碳物质的量=88×106g44g/mol=2×106mol;
二氧化碳气体的体积=2×106mol×22.4L/mol=4,48×107L
4.48×107L;
故答案为:4.48×107
本题解析:
本题难度:一般