微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 下列是A、B、C、D、E五种短周期元素的某些性质
| A | B | C | D | E
化合价
-4
-2
-1
-2
-1
电负性
2.5
2.5
3.0
3.5
4.0
|
(1)元素A是形成有机物的主要元素,下列分子中含有sp和sp3杂化方式的是______
A.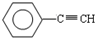 B.CH4C.CH2=CHCH3 D.CH3CH2C≡CHE.CH3CH3
B.CH4C.CH2=CHCH3 D.CH3CH2C≡CHE.CH3CH3
(2)与AD2互为等电子体的分子、离子的化学式依次为______、______(各写1种)
(3)相同条件下,AD2与BD2分子两者在水中的溶解度较大的是______(写分子式),理由是______.
参考答案:A、B、C、D、E五种短周期元素,根据元素化合价知,A属于第ⅣA族,B、D属于第ⅥA族,C、E属于第VⅡA族,B的电负性小于D,所以D是O元素,B是S元素;C的电负性小于E,所以C是Cl元素,E是F元素,硅的电负性小于S,A的电负性等于S元素,所以A是C元素,
(1)A.苯环上碳原子含有3个σ 键,采用sp2杂化,故A错误;
B.甲烷分子中碳原子含有4个σ 键,采用sp3杂化,故B错误;
C.丙烯中甲基碳原子含有4个σ 键,采用sp3杂化,碳碳双键两侧的碳原子含有3个σ 键,采用sp2杂化,故C错误;
D.1-丁炔中甲基和亚甲基中碳原子含有4个σ 键,采用sp3杂化,碳碳三键两侧的碳原子含有2个σ 键,采用sp杂化,故D正确;
E.乙烷中甲基碳原子含有4个σ 键,采用sp3杂化,故E错误;
故选D;
(2)与CO2互为等电子体的分子、离子中含有3个原子,16个价电子,所以其等电子体的分子、离子的化学式依次为N2O、SCN-,故答案为:N2O、SCN-;
(3)相同条件下,CO2与SO2分子两者在水中的溶解度较大二氧化硫,二氧化碳是非极性分子,二氧化硫是极性分子,水是极性分子,根据“相似相溶”原理知,SO2在H2O中的溶解度较大,
故答案为:SO2,因为CO2是非极性分子,SO2和H2O都是极性分子,根据“相似相溶”原理,SO2在H2O中的溶解度较大.
本题解析:
本题难度:简单
2、简答题 前四周期元素A、B、C、D、E、F,原子序数依次增大,其中A和B同周期,固态的AB2能升华;C和E原子都有一个未成对电子,C+比E-少一个电子层,E原子的一个电子后3p轨道全充满;D的最高化合价和最低化合价代数和为4,其最高价氧化物中D的质量分数为40%,且核内质子数等于中子数;F为红色单质,广泛用于电气工业.回答下列问题:
(1)元素电负性:D______E?(填>、<或=)
(2)A、C单质熔点A______C(填>、<或=)
(3)AE4中A原子杂化轨道方式为:______杂化;其固态晶体类型为______.
(4)F的核外电子排布式为______;向F的硫酸盐中逐滴加入氨水先产生沉淀,后沉淀溶解为深蓝色溶液,加入乙醇会析出蓝色晶体,该晶体中F与NH3之间的化学键为______.
(5)氢化物的沸点:B比D高的原因______;
(6)元素X的某价态阴离子Xn-中所有电子正好充满K和L电子层,CnX晶体的最小结构单元如图所示.该晶体中阳离子和阴离子个数比为______,晶体中每个Xn-被______个等距离的C+离子包围.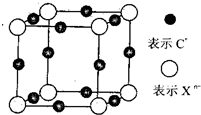
参考答案:前四周期元素A、B、C、D、E、F,原子序数依次增大,A和B同周期,固态的AB2能升华,AB2为CO2,则A为碳元素,B为氧元素;E原子的一个电子后3p轨道全充满,则E最外层电子数为7,故E为氯元素;C和E原子都有一个未成对电子,C+比E-少一个电子层,则C为钠元素;D的最高化合价和最低化合价代数和为4,D最外层电子数为6,D原子序数大于钠元素小于氯元素,故D为硫元素,其最高价氧化物SO3中S的质量分数为40%,且核内质子数等于中子数,符合题意;F为红色单质,广泛用于电气工业,F为铜元素.
(1)D为硫元素,E为氯元素,同周期自左而右,元素电负性增强,所以电负性D<E.
故答案为:<.
(2)A为碳元素,B为氧元素;碳单质金刚石为原子晶体,氧气形成分子晶体,所以熔点A>C.
故答案为:>.
(3)A为碳元素,E为氯元素,AE4为CCl4,碳原子最外层电子全部成键,成4个C-Cl键,碳原子杂化轨道数为4,采取SP3杂化,属于分子晶体.
故答案为:SP3;分子晶体.
(4)F为铜元素,核外电子数为29,F的核外电子排布式为1s22s22p63s23p63d104s1;向F的硫酸盐中逐滴加入氨水先产生沉淀,后沉淀溶解为深蓝色溶液,加入乙醇会析出蓝色晶体,该晶体为[Cu(NH3)4]SO4?H2O,晶体中铜离子与NH3之间的化学键为配位键.
故答案为:1s22s22p63s23p63d104s1;配位键.
(5)B为氧元素、D为硫元素,对应氢化物为水与硫化氢,水分子间存在氢键,增大分子间作用力,所以氢化物的沸点:B比D高.
故答案为:水分子间存在氢键,增大分子间作用力.
(6)由CnX晶体的最小结构单元可知,该晶体晶胞中Xn-数目为8×18=1,C+数目为12×14=3,所以晶体中阳离子和阴离子个数比为3:1;以右边前面顶点的Xn-研究,三条棱向上、向前、向右延伸,还有3个距离的C+离子,所以晶体中每个Xn-被6个等距离的C+离子包围.
故答案为:3:1;6.
本题解析:
本题难度:一般
3、填空题 Ⅰ.砷化镓为第三代半导体,以其为材料制造的灯泡寿命长,耗能少。已知砷化镓的晶胞结构如图所示。请回答下列问题:

?(1)下列说法正确的是____(填序号)。
A.砷化镓晶胞结构与NaCl相同
B.第一电离能As>Ga
C.电负性As>Ga
D.原子半径As>Ga
(2)砷化镓可由(CH3)3Ga和AsH3在700℃下反应制得,反应的方程式为_________________;
(3)AsH3空间形状为_______;已知(CH3)3Ga为非极性分子,则其中镓原子的杂化方式为____________;
Ⅱ.金属铜的导电性仅次于银,居金属中的第二位,大量用于电气工业。
(4)请解释金属铜能导电的原因___________,Cu2+的核外电子排布式为_________________
(5)在硫酸铜溶液中通入过量的氨气,小心蒸发,最终得到深蓝色的[Cu(NH3)4]SO4晶体,晶体中含有的化学键除普通共价键外,还有___________和____________。
参考答案:(1)BC
(2)(CH3)3Ga+AsH3 GaAs+3CH4
GaAs+3CH4
(3)三角锥;sp2
(4)铜是金属晶体,由金属阳离子和自由电子构成,自由电子在外加电场的作用下可发生定向移动;
[Ar]3d9或1s22s22p63s23p63d9
(5)离子键;配位键
本题解析:
本题难度:一般
4、选择题 下列说法中正确的是( )
A.二氯甲烷(CH2Cl2)分子的中心原子是SP3杂化,键角均为109°28′
B.CH2O和ClO4-的中心原子上都含有孤对电子
C.BCl3、PCl5、H2O分子中均有一个原子的最外层电子不满足了8e-稳定结构
D.由原子间通过共价键形成的晶体一定比其他类别晶体熔、沸点高
参考答案:C
本题解析:
本题难度:一般
5、填空题 (1)下表是A、B、C、D、E五种短周期元素的某些性质

①A元素是形成有机物的主要元素,下列分子中采取sp和sp3两种杂化方式的是________
 B.CH4 C.CH2=CHCH3 D.CH3CH2C
B.CH4 C.CH2=CHCH3 D.CH3CH2C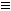 CH E.CH3CH3
CH E.CH3CH3
②与AD2互为等电子体(等电子体是指一类分子或离子,组成它们的原子数相同,而且所含的价层电子数也相同)的分子、离子的化学式依次为_________、__________(各写1种)。
③相同条件下,AD2与BD2在水中的溶解度较大的是______(填化学式),理由是_________________。
(2)下表是部分金属元素的电离能

④已知X、Y、Z的价层电子构型为ns1,则三种金属氯化物(RCl)的熔点由低到高的顺序为_________。
⑤CuCl可用作有机合成催化剂,并用于颜料、防腐等工业。CuCl的晶体结构如图所示。Cu+的电子排布式为____________,与同一个Cu+相连的Cl-有______个。

参考答案:(1)①D;②N2O;SCN-;③SO2;因为CO2是非极性分子,SO2和H2O都是极性分子,根据“相似相溶”原理,SO2在水中的溶解度较大
(2)④ZCl<YCl<XCl;⑤[Ar]3d10;4
本题解析:
本题难度:一般