1?实验①和②探究盐酸浓度对该反应速率的影响;
2实验①和③探究温度对该反应速率的影响;
3实验①和④探究金属规格(铝片、铝粉)对该反应速率的影响.
①
25?C
铝片
4.0
②
③
④
参考答案:Ⅰ(1)离子方程式书写时,单质写化学式,易溶于水的强电解质写离子,故答案为:2Al+6H+=2Al3++3H2↑
(2)该反应是放热反应,随着反应的进行,放出的能量越多,溶液的温度升高,温度越高反应速率越快,
故答案为:反应放热使溶液温度升高,从而使化学反应速率加快
(3)盐酸和硫酸溶液中氢离子浓度相同,不同点是阴离子不同,
故答案为:1、Cl-能够促进金属铝与H+反应,或SO42-对H+与金属铝的反应起阻碍作用等.
(Ⅱ)(1)1、②根据题意知,①和②只有盐酸浓度不同,其它完全相同进行实验.
2、③根据题意,实验①和③只有温度不同,其它完全相同进行实验.
3、④根据题意,实验①和④只有金属规格不同,其它完全相同进行实验.
故答案为:
实验编号温度金属铝规格盐酸浓度/mol?L-1②25℃铝片2.0③35℃铝片4.0④25?C铝粉4.0
本题解析:
本题难度:一般
2、选择题 下列有关化学反应速率的说法正确的是( )
A.汽车尾气中的NO和CO可以缓慢反应生成N2和CO2,减小压强反应速率减慢
B.100?mL?2?mol/L的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变
C.SO2的催化氧化是一个放热的反应,所以升高温度,反应速率减慢
D.用铁片和稀硫酸反应制取氢气时,改用98%的浓硫酸可以加快产生氢气的速率
参考答案:A.汽车尾气中的NO和CO可以缓慢反应生成N2和CO2,为有气体参加的化学反应,则减小压强反应速率减慢,故A正确;
B.100?mL?2?mol/L的盐酸跟锌片反应,加入适量的氯化钠溶液,氢离子浓度变小,反应速率减小,故B错误;
C.SO2的催化氧化是一个放热的反应,但升高温度,反应速率加快,故C错误;
D.用铁片和稀硫酸反应制取氢气时,改用98%的浓硫酸不生成氢气,故D错误;
故选A.
本题解析:
本题难度:简单
3、选择题 100 mL 6 mol·L-1的硫酸溶液跟过量锌粉反应,在一定温度下,为了减缓反应进行的速率,又不影响生成氢气的总量,可向反应物中加入适量的( )
A.Na2CO3固体
B.3 mol·L-1的H2SO4溶液
C.CH3COOK溶液
D.KNO3溶液
参考答案:C
本题解析:此反应实质是2H++Zn Zn2++H2↑,又因为要求不影响生成氢气的总量,因此不能改变H+的物质的量。加Na2CO3溶液,会生成CO2,影响生成H2的总量,故A项错;加入3 mol·L-1的H2SO4溶液,会生成更多H2,故B项错;加入KNO3溶液,Zn与H+、N反应生成NO,减少了H+的物质的量,影响氢气的生成量,故D项错;加入CH3COOK溶液,使c(H+)减小,反应速率减慢,但H+的总物质的量不变,生成的n(H2)不变,故C项正确。 Zn2++H2↑,又因为要求不影响生成氢气的总量,因此不能改变H+的物质的量。加Na2CO3溶液,会生成CO2,影响生成H2的总量,故A项错;加入3 mol·L-1的H2SO4溶液,会生成更多H2,故B项错;加入KNO3溶液,Zn与H+、N反应生成NO,减少了H+的物质的量,影响氢气的生成量,故D项错;加入CH3COOK溶液,使c(H+)减小,反应速率减慢,但H+的总物质的量不变,生成的n(H2)不变,故C项正确。
本题难度:一般
4、选择题 等质量的两份锌粉a、b分别加入到两份质量相同的过量的稀硫酸中,同时向a中加入少量的CuSO4溶液,下列各图为产生H2的体积V(L)与时间t(min)的关系,其中正确的是(?)
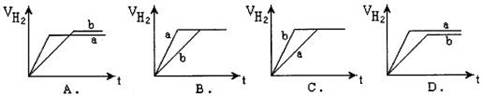
参考答案:A
本题解析:向a中加入少量的CuSO4溶液,部分锌和硫酸铜反应,生成的氢气减少,生成的铜覆盖在锌的表面,构成原电池,加快反应速率,故选A。
本题难度:一般
5、选择题 符合图象的反应为( )。
A.N2O3(g) NO2(g)+NO(g) NO2(g)+NO(g)
B.3NO2(g)+H2O(l) 2HNO3(l)+NO(g) 2HNO3(l)+NO(g)
C.4NH3(g)+5O2(g) 4NO(g)+6H2O(g) 4NO(g)+6H2O(g)
D.CO2(g)+C(s) 2CO(g) 2CO(g)
|