微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点.右图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流.试回答下列问题:
(1)图中通过负载的电子流动方向______(填“向左”或“向右)
(2)写出氢氧燃料电池工作时电极反应方程式和总反应方程式正极:______负极:______总反应:______
(3)为了获得氢气,除了充分利用太阳能外,工业上利用石油产品与水在高温、催化剂作用下制取氢气.写出丙烷和H2O反应生成H2和CO的化学方程式:______
(4)若将此燃料电池改进为直接以甲烷和氧气为原料进行工作时,负极反应式为______,电池总离子反应方程式为______.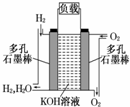
参考答案:(1)根据原电池工作原理,负极上失电子,电子从负极沿外电路流向正极,所以通过负载的电子流动方向是向右.
故答案为:向右;
(2)正极上氧气得电子和水生成氢氧根离子,发生还原反应,所以电极反应式为2H2O+O2+4e-═4OH-;负极上失电子和氢氧根离子反应生成水,所以电极反应式为2H2+4OH--4e-═4H2O;两极上的电极反应式相加得总反应方程式,所以总反应方程式为2H2+O2═2H2O.
故答案为:2H2O+O2+4e-═4OH-;2H2+4OH--4e-═4H2O;2H2+O2═2H2O;
(3)该反应中反应物是丙烷和H2O,产物是H2和CO,反应条件是高温、催化剂,所以方程式为
C3H8+3H2O?催化剂?.高温3CO+7H2.故答案为:C3H8+3H2O?催化剂?.高温3CO+7H2;
(4)负极上是燃料失电子,正极上是氧气得电子,所以负极上甲烷反应生成二氧化碳,二氧化碳是酸性氧化物,能和电解质溶液KOH反应生成盐和水,所以正极上的电极反应式为CH4+10OH--8e-═CO32-+7H2O;正极上氧气得电子和水生成氢氧根离子;正负极上的电极反应式相加得总反应方程式,所以总反应方程式为CH4+2O2+2OH-═CO32-+3H2O.
故答案为:CH4+10OH--8e-═CO32-+7H2O;CH4+2O2+2OH-═CO32-+3H2O.
本题解析:
本题难度:一般
2、选择题 下图所示装置能够组成原电池,并且能产生明显电流的是( )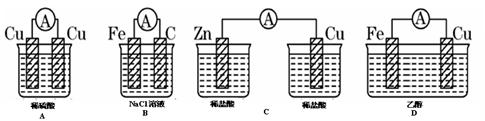
参考答案:B
本题解析:构成原电池的条件是活泼性不同的金属或金属和非金属,导线相连并插入到电解质溶液中,因此B正确,A中电极相同,C中没有构成回路,D中乙醇不是电解质,答案选B。
考点:考查原电池的构成
点评:该题属于基础性试题,难度不大。该题容易错选C,但选项C中如果添加盐桥则可以构成原电池。
本题难度:一般
3、填空题 如图是以铅蓄电池为电源,模拟氯碱工业电解饱和食盐水的装置图(C、D均为石墨电极).
电解一段时间后,若在电解池中C极一侧出来的气体无色无味,D极一侧出来的气体呈黄绿色有刺激性气味.请回答以下问题:
(1)已知铅蓄电池在放电时发生的反应:Pb+PbO2+4H++2SO42-=2PbSO4+2H2O,则
A极为______极,发生______反应,电极反应为______
B极为______极,发生______反应,电极反应为______
(2)请写出电解饱和食盐水的化学方程式______.
C极为______极,发生______反应,电极反应为______
D极为______极,发生______反应,电极反应为______
(3)用铅蓄电池电解1L饱和食盐水(食盐水足量、密度为1.150g/cm3)时,若电路上有0.2mol电子的电量通过,则
①铅蓄电池消耗H2SO4______?mol.
②电解池中收集到______?L(标准状况下)氯气(假设氯气全部排出).
③所得NaOH溶液中的物质的量浓度=______.剩余NaCl的密度为______(假设体积不变).
(4)氯碱工业生产中的电解饱和食盐水池中所用的高分子隔膜叫做______膜,所起的主要作用有
①______
②______
③______.
参考答案:电解一段时间后,若在电解池中C极一侧出来的气体无色无味氢气,则C极是阴极,D极一侧出来的气体呈黄绿色有刺激性气味氯气,D极是阳极,所以原电池中A极是负极,B极是正极;
(1)A是负极,负极上铅失电子和硫酸根离子反应生成硫酸铅,该反应属于氧化反应,电极反应式为:Pb+SO42--2e-=PbSO4,
B是正极,正极上二氧化铅得电子和硫酸反应生成硫酸铅、水,该反应属于还原反应,电极反应式为:PbO2+4H++SO42-+2e-=PbSO4+2H2O,
故答案为:负,氧化,Pb+SO42--2e-=PbSO4;正,还原,PbO2+4H++SO42-+2e-=PbSO4+2H2O;
(2)电解氯化钠溶液时,C是阴极,阴极上得电子发生还原反应,电极反应式为:2H2O+2e-=H2 +2OH-↑,D是阳极,阳极上氯离子失电子发生氧化反应,电极反应式为:2Cl--2e-=Cl2↑,同时生成氢氧化钠,所以其电池反应式为:2NaCl+2H2O?电解?.?2NaOH+H2↑+Cl2↑,
故答案为:2NaCl+2H2O?电解?.?2NaOH+H2↑+Cl2↑,阴极,还原,2H2O+2e-=H2 +2OH-↑,阳极,氧化,2Cl--2e-=Cl2↑;
(3)Pb+PbO2+2H2SO4=2PbSO4+2H2O转移电子
?2mol?2mol
根据硫酸和转移电子的关系知,当转移2mol电子时,消耗硫酸的物质的量是2mol,则转移0.2mol电子时消耗硫酸的物质的量是0.2mol;
2NaCl+2H2O?电解?.?2NaOH+H2↑+Cl2↑转移电子
? 22.4L? 2mol
根据氯气和转移电子的关系式知,当生成22.4L氯气时转移电子的物质的量是2mol,当转移0.2mol电子时生成2.24L氯气;
2NaCl+2H2O?电解?.?2NaOH+H2↑+Cl2↑转移电子
? 2mol? 2mol
根据氢氧化钠和转移电子的关系式知,生成2mol氢氧化钠时转移电子的物质的量是2mol,当转移0.2mol电子时生成0.2mol氢氧化钠,C(NaOH)=0.2mol1L=0.2mol/L;
2NaCl+2H2O?电解?.?2NaOH+H2↑+Cl2↑转移电子
117g? ? 2mol
根据氯化钠和转移电子的关系式知,当转移2mol电子消耗117g氯化钠,则转移0.2mol电子时消耗11.7g氯化钠,溶液中含有氯化钠的质量=1.150g/cm3×1000cm3-11.7g=1138.3g,ρ=1138.3g1000cm3=1.138g/cm3,
故答案为:0.2,2.24,0.2mol/L,1.138g/cm3;
(4)氯碱工业生产中的电解饱和食盐水池中所用的高分子隔膜叫做阳离子膜,其作用有:让阳离子钠离子穿过达到,阻止氯离子和氢氧根离子穿过,防止氯气和氢气接触而发生反应,防止氯气和氢氧化钠接触发生反应,
故答案为:阳离子,让阳离子钠离子穿过达到,阻止氯离子和氢氧根离子穿过,防止氯气和氢气接触而发生反应,防止氯气和氢氧化钠接触发生反应.
本题解析:
本题难度:一般
4、选择题 将等质量的a、b两份锌粉装入试管中,分别加入过量的稀硫酸,同时向装a的试管中加入少量CuSO4溶液。下图表示产生氢气的体积V与时间t的关系,其中正确的是
[? ]
A.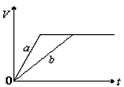
B.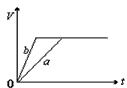
C.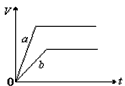
D.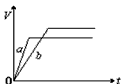
参考答案:D
本题解析:
本题难度:一般
5、选择题 有关下图所示原电池的叙述不正确的是
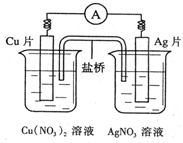
A.电子沿导线由Cu片流向Ag片
B.正极的电极反应是Ag++e-=Ag
C.Cu片上发生氧化反应,Ag片上发生还原反应
D.盐桥中盛装的是含琼脂的饱和氯化钾溶液,钾离子流向银半电池
参考答案:D
本题解析:原电池中较活泼的金属作负极,较不活泼的金属作正极,铜比银活泼,铜是负极,失去电子,发生氧化反应。银是正极,电子经导线传递到正极上,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应。所以选项ABC均正确,D不正确,因为盐桥中盛装的是含琼脂的硝酸银溶液,答案选D。
本题难度:简单