|
高中化学知识点归纳《原电池原理》答题技巧(2017年最新版)(四)
2017-08-10 00:48:40
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 将Fe片和Zn片放在盛有NaCl溶液(其中滴有酚酞)的表面皿中,如图所示.最先观察到变为红色的区域为( )
A.I和Ⅲ
B.I和Ⅳ
C.II和III
D.II和Ⅳ
| 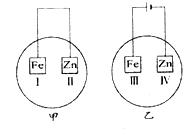
参考答案:甲图示是原电池,锌做负极,锌失电子形成锌离子,正极是Ⅰ,在正极上,O2+2H2O+4e-=4OH-;所以Ⅰ处变红;
乙图示是电解池,铁做阳极,铁失电子生成亚铁离子,锌做阴极,在阴极上,2H++2e-=H2↑,破坏了锌片附近水的电离平衡,使得OH-浓度增大,所以Ⅳ处也变红.
故选B.
本题解析:
本题难度:简单
2、选择题 电子表和电子计算机的电源通常用微型银-锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH溶液总反应式:Ag2O?+?H2O+?Zn=Zn(OH)2?+?2Ag?下列说法正确的是
A.Ag2O是正极, Zn是负极
B.Zn是正极,Ag2O是负极
C.工作时,电池负极区溶液PH增大
D.工作时,电子由Ag2O极经外电路流向Zn极
参考答案:A
本题解析:根据总反应式可知氧化银得到电子被还原,锌失去电子被氧化。因此氧化银是正极,锌是负极,电子经外电路由氧化银流向锌极,其中负极电极反应式为Zn-2e-+2H2O=Zn(OH)2+2H+。所以正确的答案是A。
本题难度:简单
3、选择题 现有A、B、C、D四种金属片,①把A、B用导线连接后同时浸入稀硫酸中,B上有气泡产生;②把C、D用导线连接后同时浸入稀硫酸中,C上发生还原反应;③把B、D用导线连接后同时浸入稀硫酸中,电子流动方向为:B→导线→D,则下列关于金属活动由强到弱顺序正确的是
A.B>A>C>D? B.A>B>D>C? C.A>B>C>D? D.B>A>D>C
参考答案:B
本题解析:在原电池中,负极金属的活泼性一般强于正极金属的活泼性,根据原电池的工作原理判断电池的正负极,进而可以判断金属的活泼性强弱关系。
①A、B用导线相连后,同时浸入稀硫酸中,B上有气泡产生,说明A是负极,B是正极,所以活泼性:A>B;②把C、D用导线连接后同时浸入稀硫酸中,C上发生还原反应,说明C是正极,D是负极,则金属性是D>C;③把B、D用导线连接后同时浸入稀硫酸中,电子流动方向为:B→导线→D,这说明B是负极,D中正极,则金属性是B>D,综上可知金属活泼性顺序是:A>B>D>C,答案选B。
点评:该题是中等难度的试题,试题针对性强,难易适中,有利于调动学生的学习兴趣和学习积极性。明确原电池的工作原理,特别是电极名称的判断,然后依据原电池中反应现象判断金属的活泼性是解题的关键。
本题难度:一般
4、填空题 将洁净的金属片A、B、C、D分别放置在浸有盐溶液的滤纸上面并压紧(如图所示)。在每次实验时,记录电压指针的移动方向和电压表的读数如下表如示
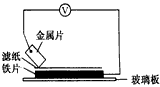 
已知构成原电池两电极的金属活动性相差越大,电压表读数越大。请判断:
(1)A、B、C、D四种金属中活泼性最强的是____________(用字母表示)。
(2)若滤纸改用NaOH溶液浸润一段时间后,则在滤纸上能看到有白色物质析出,后迅速变为灰绿色,最后变成褐色。则滤纸上方的金属片为____________(用字母表示),此时负极反应__________________________________。
参考答案:(1)C
(2)B;2Fe-4e-=2Fe2+
本题解析:
本题难度:一般
5、填空题 下列说法正确的是?
[?]
A.取少量溶液X,向其中加入适量新制氯水,再加几滴KSCN溶液,溶液变红,说明X溶液中一定含有Fe2+
B.向NaClO溶液中通入足量SO2的离子方程式是:ClO-+SO2+H2O=HClO+HSO3-
C.铅蓄电池放电时的负极和充电时的阴极均发生氧化反应
D.氢氧化铁胶体和氯化铁溶液分别加热蒸干并灼烧,最终得到的物质成分相同
参考答案:D
本题解析:
本题难度:一般
| 