微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在常温下,下列溶液不能溶解铁的是
[? ]
A. 稀硫酸
B. FeCl3溶液
C. CuCl2
D. 浓硫酸
参考答案:D
本题解析:
本题难度:简单
2、选择题 为了将FeCl2溶液转化成FeCl3溶液,最好的方法是向此溶液中
A.通入氯气
B.加入HCl
C.加入Fe
D.加入Cu
参考答案:A
本题解析:氯气不但能氧化FeCl2,而且还生成FeCl3,不引入任何杂质粒子,答案为A
本题难度:一般
3、简答题 含铁元素的物质有很多,它们对人体健康、生产生活都有重要作用,请完成以下填空:
(1)指出下列化合物中铁元素的化合价(O均为-2价):Fe(OH)2______?Fe2O3______?Na2FeO4______
(2)取少量某品牌油漆的原料Fe2O3(红棕色粉末)并加入适量盐酸,反应后得到棕黄色FeCl3溶液,取少量棕黄色溶液置于试管中,滴入NaOH溶液,可观察到Fe(OH)3沉淀生成,生成沉淀的离子方程式为______.另在小烧杯中加入30mL蒸馏水,加热至沸腾后,向沸水中滴入2mL?上述棕黄色溶液,继续加热至______色液体,停止加热,用______物理方法证明所得分散系的类别,写出制备该分散系的化学方程式______.
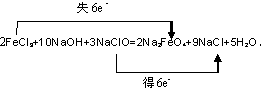
(3)高铁酸钠(Na2FeO4)能有效地杀灭水中的病菌.工业制备Na2FeO4的化学方程式:
2FeCl3+10NaOH+3NaClO=2Na2FeO4+9NaCl+5H2O(O均为-2价),请用双线桥表示该反应的电子转移方向和总数______.
(4)一个体重50kg的健康人含铁元素2g,Fe2+易被人体吸收,所以给贫血者补充铁时,服用维生素C可使食物中的Fe3+转化成Fe2+,有利于人体对铁的吸收.维生素C在这个反应中表现______(“氧化性”“还原性”).
参考答案:(1)化合物中各元素的化合价的代数和为0,所以Fe(OH)2?中,氢氧根离子显-1价,所以铁元素显+2价;
?Fe2O3?中氧元素显-2价,所以铁元素显+3价;?Na2FeO4中,钠元素显+1价,氧元素显-2价,所以铁元素显+6价.
故答案为:+2;+3;+6.
(2)根据题意知,反应物是氢氧化钠和氯化铁,生成物是氢氧化铁沉淀,所以离子方程式为:Fe3++3OH-═Fe(OH)3↓;向沸水中滴加氯化铁溶液可制得红褐色氢氧化铁胶体,
离子反应为Fe3++3H2O(沸水)═Fe(OH)3(胶体)+3H+,氢氧化铁胶体具有丁达尔效应.
故答案为:Fe3++3OH-═Fe(OH)3↓;红褐色;丁达尔效应;Fe3++3H2O(沸水)═Fe(OH)3(胶体)+3H+;
(3)2FeCl3+10NaOH+3NaClO=2Na2FeO4+9NaCl+5H2O,该方程式中,一个铁原子由+3价失3个电子变成+6价,2个铁原子失去6个电子,NaClO中的Cl元素的原子得2个电子,3个Cl原子得6个电子,所以转移电子数为6.
故答案为:
(4)Fe3+转化成Fe2+,Fe3+体现氧化性,在氧化还原反应中,氧化剂和还原剂同时存在,服用维生素C可使食物中的Fe3+转化成Fe2+,所以维生素C体现还原性.
故答案为:还原性.
本题解析:
本题难度:一般
4、实验题 (10分) 铁是人体必须的微量元素,治疗缺铁性贫血的常见方法是服用补铁药物。“速力菲”(主要成分:琥珀酸亚铁,呈暗黄色)是市场上一种常见的补铁药物。该药品不溶于水但能溶于人体中的胃酸。某同学为了检测“速力菲”药片中Fe2+的存在,设计并进行了如下实验:

⑴试剂1是?。
⑵加入KSCN溶液后,在未加新制氯水的情况下,溶液中也产生了红色,其可能的原因是?。
⑶在实验中发现放置一段时间,溶液的颜色会逐渐褪去。为了进一步探究溶液褪色的原因,甲、乙、丙三位同学首先进行了猜想:
编号
| 猜?想
|
甲
| 溶液中的+3价Fe又被还原为+2价Fe
|
乙
| 溶液中的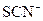 被过量的氯水氧化 被过量的氯水氧化
|
丙
| 新制的氯水具有漂白性,将该溶液漂白
|
基于乙同学的猜想,请设计实验方案,验证乙同学的猜想是否正确。写出有关的实验操作、预期现象和结论。(不一定填满,也可以补充)
⑷另一同学为了检测“速力菲”药片中铁的含量,设计并进行了如下实验:
①取样、碾碎,并称取2.0g,加入过量盐酸,搅拌使其完全溶解;
②向所得溶液中先加入足量H2O2溶液,再加入足量氨水,充分反应后过滤并洗涤沉淀;
③将所得固体灼烧至恒重,得0.8g红棕色固体。
④计算:“速力菲”药片中铁的质量分数为?。
参考答案:(10分)
⑴稀盐酸(或稀硫酸溶液)(2分)
⑵Fe2+被空气中氧气氧化成Fe3+;(2分)
⑶(4分)
编号
实验操作
预期现象和结论
①
取少量褪色后溶液,加入KSCN溶液
如果溶液变红色,说明乙同学的猜想是合理的;如果溶液不变红色,说明乙同学的猜想是不合理的
或
取少量褪色后溶液,加 入FeCl3溶液
入FeCl3溶液
如果溶液仍不变红色,说明乙同学的猜想是合理的;如果溶液变红色,说明乙同学的猜想是不合理的
本题解析:略
本题难度:简单
5、实验题 人教版《必修1》关于Fe3+和Fe2+的转化的实验探究,某校教师为了检验学生完成每个实验过程时相应的问题解决思路,特设计一份化学探究学习“过程-思路”问卷。
(1)请在下表中右栏填写设计每一步操作过程的思路
过程
| 思路
|
1.提出假设:Fe2+具有还原性,可以被氧化成Fe3+;Fe3+具有氧化性,可以被还原成Fe2+
| ①根据氧化还原反应原理,一般?物质有还原性,??物质有氧化性
|
2.设计实验1:取少量FeCl2溶液,滴加几滴H2O2溶液,再向溶液中滴加几滴KSCN溶液,观察溶液是否变血红色
| ②用离子方程式表示选择H2O2的原因?
③用离子方程式表示溶液变血红色的原因?
|
3.设计实验2:取少量FeCl3固体于一试管,用已煮沸的蒸馏水溶解,滴加几滴KSCN溶液后迅速加入少量铁粉,盖上试管塞,观察溶液的血红色是否褪去
| ④选择铁粉的原因是?(用化学方程式表示)
⑤为什么要用煮沸的水?
|
4.实施实验
| ……
|
……
| ……
|
?
(2)教材中实验方案如下:取2mLFeCl3溶液,加入少量铁粉,充分反应后,滴入几滴KSCN溶液,观察并记录实验现象。把上层清液倒入另一试管中,再滴入几滴氯水,又发生了什么变化?学生通过实践证明,实验效果很差:没有预期的红色出现,而是很淡的浅红色,试分析实验中出现异常的可能原因并加以改进使实验现象更明显。
⑥可能的原因:?
⑦改进措施:?
参考答案:
(1)①低价(态)?高价(态) (1+1=2分)
②2Fe2+ + H2O2 + 2H+ = 2Fe3+ + 2H2O(2分)
③Fe3+ +3SCN- = Fe(SCN)3(2分)
④2FeCl3+ Fe = 3FeCl2(2分)
⑤除去水中的O2,防止生成的Fe2+被氧化(2分)
(2)⑥原因:SCN-具有还原性,氯水可能部分氧化SCN-;(2分)
⑦改进:取适量FeCl3溶液,加入足量铁粉,然后将所得溶液分装于a、b两支试管,向a试管中直接滴加KSCN溶液,没有明显现象;向b试管中先滴加几滴新制的氯水,后滴加KSCN溶液,溶液立即变红色。(只要合理即可以给分)(2分)
本题解析:实验探究题(1)①根据所给出的离子,从化合价的角度分析氧化还原性,低价物质具有还原性,高价物质具有氧化性;②加入双氧水具有氧化性把Fe2+氧化成Fe3+④铁粉用来还原Fe3+转化为Fe2+;⑤除去溶液中溶解的气体一般采用加热的方法,因为温度高气体溶解度降低;(2)溶液颜色没有出现红色,原因可能是Fe3+ 和SCN-缺少一种,溶液中氯水能氧化出Fe3+ ?,所以结果只有一种可能就是SCN-被氧化。为了避免SCN-氧化,应先加入氯水后,在加入KSCN溶液,具体操作应为取适量FeCl3溶液,加入足量铁粉,然后将所得溶液分装于a、b两支试管,向a试管中直接滴加KSCN溶液,没有明显现象;向b试管中先滴加几滴新制的氯水,后滴加KSCN溶液,溶液立即变红色。
本题难度:一般