微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 若100 ℃时纯水电离出的H+浓度为1.0×10-6 mol·L-1,则此时KW= ,c(OH-)= ;25 ℃时的c(H+)=10-2 mol·L-1的硫酸溶液和c(H+)=10-12 mol·L-1的氢氧化钠溶液温度均升高到100 ℃,H+浓度分别是多少?
参考答案:10-12 1.0×10-6 mol·L-1 10-2 mol·L-1 10-10 mol·L-1
本题解析:纯水电离出的H+浓度与纯水电离出的OH-浓度相等,均为1.0×10-6 mol·L-1,此时KW=10-12;25 ℃时的c(H+)=10-2 mol·L-1的硫酸溶液温度升高到100 ℃时,c(H+)不变仍为10-2 mol·L-1;而此温度下c(H+)=10-12 mol·L-1的氢氧化钠溶液温度升高到100 ℃时,c(OH-)也不变,仍为10-2 mol·L-1,而c(H+)=KW/c(OH-)= mol·L-1=10-10 mol·L-1。
本题难度:一般
2、实验题 (10分)用中和滴定法测定某烧碱样品的纯度,试根据实验回答下列问题:
(1)准确称量8.2 g含有少量中性易溶杂质(不与盐酸反应)的样品,配成500 mL待测溶液。称量时,样品可放在??(填编号字母)称量。
A.小烧杯中? B.洁净纸片上? C.托盘上
(2)滴定时,用0.2000 mol·L-1的盐酸来滴定待测溶液,不可选用??(填编号字母)作指示剂。
A.甲基橙? B.石蕊? C.酚酞? D.甲基红
(3)滴定过程中,眼睛应注视?;
在铁架台上垫一张白纸,其目的是?。
(4)根据下表数据,计算被测烧碱溶液的物质的量浓度是?mol·L-1,烧碱样品的纯度是?。
滴定次数
| 待测溶液体积(mL)
| 标准酸体积
|
滴定前的刻度(mL)
| 滴定后的刻度(mL)
|
第一次
| 10.00
| 0.40
| 20.50
|
第二次
| 10.00
| 4.10
| 24.00
|
(5)下列实验操作对滴定结果产生什么影响(填“偏高”、“偏低”或“无影响”)?
①观察酸式滴定管液面时,开始俯视,滴定终点平视,则滴定结果________。
②若将锥形瓶用待测液润洗,然后再加入10.00 mL待测液,则滴定结果________。
参考答案:(1)A(1分)? (2)B(1分) (3)锥形瓶内溶液颜色的变化(1分)
便于观察锥形瓶内液体颜色的变化,减小滴定误差(1分)
(4)0.4000(2分)? 97.56%(2分)? (5)①偏高(1分)?②偏高(1分)
本题解析:(1)由于氢氧化钠具有吸水性和腐蚀性,所以秤量时应该放在烧杯中,答案选A。
(2)由于石蕊试液的颜色变化不明显,所以一般不用石蕊试液作酸碱指示剂,答案选B。
(3)滴定的关键是准确判断滴定终点,因此在滴定过程中眼睛要注视锥形瓶内溶液颜色的变化。白纸其对照作用,便于观察锥形瓶内液体颜色的变化,减小滴定误差。
(4)两次滴定所消耗的盐酸体积是20.10ml和19.90ml,其平均值是20.00ml。所以氢氧化钠溶液的是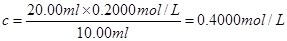 。
。
(5)①滴定管俯视读数则读数偏小,所以开始俯视,滴定终点平视,则消耗盐酸的体积偏大,滴定结果偏高。
②若将锥形瓶用待测液润洗,则消耗盐酸的体积偏大,滴定结果偏高。
本题难度:一般
3、选择题 通常人们把拆开1 mol某化学键所吸收的能量或形成1 mol某化学键所释放的能量看作该化学键的键能,键能的大小可用于估算化学反应的反应热(ΔH),已知
化学健
| H-H
| Cl-Cl
| H-Cl
|
键能
| 436 kJ·mol-1
| 243 kJ·mol-1
| 431 kJ·mol-1
|
?
则下列热化学方程式不正确的是( )
A.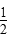 H2(g)+
H2(g)+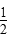 Cl2(g)=HCl(g)ΔH=-91.5 kJ·mol-1
Cl2(g)=HCl(g)ΔH=-91.5 kJ·mol-1
B.H2(g)+Cl2(g)=2HCl(g)ΔH=-183 kJ·mol-1
C.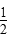 H2(g)+
H2(g)+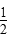 Cl2(g)=HCl(g)ΔH=91.5 kJ·mol-1
Cl2(g)=HCl(g)ΔH=91.5 kJ·mol-1
D.2HCl(g)=H2(g)+Cl2(g)ΔH=183 kJ·mol-1
参考答案:C
本题解析:化学反应的实质是旧键断裂,新键生成,断键吸热,成键放热,根据各化学
键的键能可知H2和Cl2的反应是放热反应,C错误,A、B、D中ΔH的数据与化
学方程式中的系数关系是正确的。
本题难度:一般
4、选择题 下列各碱溶液,当其pH相同时,物质的量浓度最大的是
A.KOH
B.NH3·H2O
C.Ba(OH)2
D.NaOH
参考答案:B
本题解析:略
本题难度:一般
5、填空题 已知甲烷的燃烧热为890.3 kJ/mol请完成表示甲烷燃烧熟的热化学方程式
参考答案:CH4(g)+2O2(g)=CO2(g)+2H2O(1)△H=-890.3kJ/mol
本题解析:略
本题难度:一般