微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 25℃时,下列说法正确的是
A.pH =8.3的NaHCO3溶液:c( Na+)>c( HC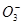 )>c(C
)>c(C 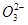 )>c( H2CO3)
)>c( H2CO3)
B.中和同浓度同体积的盐酸和醋酸,消耗的NaOH的物质的量不相同
C.用一定浓度的NaOH溶液滴定氢氟酸,当pH =6时,溶液中c(F—)—c(Na+)=9.9×l0—7 mol/L
D.用NaOH溶液滴定HCI与CH3COOH的混合溶液至中性时,溶液中的酸被完全中和
参考答案:C
本题解析:A、pH =8.3的NaHCO3溶液,溶液呈碱性,说明水解大于电离,c( H2CO3)>c(C 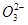 ),A不正确;B、同浓度同体积的盐酸和醋酸中溶质的物质的量相同,中和同浓度同体积的盐酸和醋酸,消耗的NaOH的物质的量相同,B不正确;C、由电荷守恒,c(F—)—c(Na+)=c(H+ )—c(OH―)=10―6―10―8=9.9×l0—7 mol/L,C正确;D、醋酸是弱酸,中和至中性时,溶液中酸过量,D不正确;选C。
),A不正确;B、同浓度同体积的盐酸和醋酸中溶质的物质的量相同,中和同浓度同体积的盐酸和醋酸,消耗的NaOH的物质的量相同,B不正确;C、由电荷守恒,c(F—)—c(Na+)=c(H+ )—c(OH―)=10―6―10―8=9.9×l0—7 mol/L,C正确;D、醋酸是弱酸,中和至中性时,溶液中酸过量,D不正确;选C。
考点:电解质溶液
本题难度:一般
2、选择题 25 ℃时,在等体积的①pH=0的H2SO4溶液,②0.05 mol·L-1的Ba(OH)2溶液,③pH=10的Na2S溶液,④pH=5的NH4NO3溶液中,发生电离的水的物质的量之比是( )
A.1∶10∶1010∶109
B.1∶5∶5×109∶5×108
C.1∶20∶1010∶109
D.1∶10∶104∶109
参考答案:A
本题解析:由水电离的氢离子的浓度是
1、pH=0的H2SO4溶液,由Kw=C(H+)*C(OH-),可得,C(H+)="10^-14" mol/L
2、0.05mol/L的Ba(OH)2溶液,由Kw=C(H+)*C(OH-),可得C(H+)=10^-13mol/L
3、pH=10的Na2S溶液,由Kw=C(H+)*C(OH-),可得C(H+)=10^-4mol/L
4、pH=5的NH4NO3溶液中,由Kw=C(H+)*C(OH-),可得C(H+)=10^-5mol/L
本题难度:简单
3、选择题 下列在指定溶液中的各组离子,能够大量共存的是(?)
A.无色溶液中: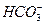 、Na+、Cl-、OH-
、Na+、Cl-、OH-
B.pH=11的溶液中:S2-、K+、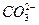 、Cl-
、Cl-
C.pH=1的溶液中:Fe2+、 、Mg2+、
、Mg2+、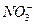
D.水电离的c(H+)=10-12 mol·L-1的溶液中:Fe3+、 、K+、SCN-
、K+、SCN-
参考答案:B
本题解析:碳酸氢根离子既不能与酸共存,也不能与碱共存;酸性条件下硝酸根离子会氧化亚铁离子;硫氰根离子和三价铁离子作用生成络合物。
本题难度:简单
4、填空题 (8分)已知下列热化学方程式:①2H2(g) +O2(g)=2H2O(l);ΔH= -570 kJ·mol-1
②2H2(g) +O2(g)=2H2O(g)? ΔH= -483.68 kJ·mol-1
③2C(s) +O2(g)=2CO(g)? ΔH=-221 kJ·mol-1
④ C(s) +O2(g)=CO2(g)? ΔH= -393.5 kJ·mol-1?
回答下列问题:
(1)H2的燃烧热为?;C的燃烧热为?。
(2)燃烧10gH2生成液态水,放出的热量为?。
(3)写出CO燃烧的热化学方程式?。
参考答案:(1)285KJ/mol、393.5KJ/mol?(2)1425KJ
(3)CO(g) + O2(g)=CO2(g);ΔH=-283KJ/mol
O2(g)=CO2(g);ΔH=-283KJ/mol
本题解析:(1)燃烧热是在一定条件下,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量。所以氢气的燃烧热是285KJ/mol。C的燃烧热为393.5KJ/mol。
(2)10g氢气是5mol,放出的热量是285KJ/mol×5mol=1425KJ。
(3)④×2-③得到2CO(g) +O2(g)=2CO2(g)?ΔH= -566 kJ·mol-1?。
本题难度:简单
5、选择题 把1 mL 0.1 mol/L的H2SO4加水稀释成2 L溶液,在此溶液中由水电离产生的H+,其浓度接近于
A.1×10-4 mol/L
B.1×10-8 mol/L
C.1×10-11 mol/L
D.1×10-10 mol/L
参考答案:D
本题解析:
正确答案:D
C(H+)=1×10―3?L×0.1 mol/L×2÷2?L=1×10―4mol/L,由水电离出的H+ 为10-14/1×10―4=1×10-10mol/L
本题难度:一般