|
高中化学知识点大全《燃烧热》高频试题特训(2017年最新版)(八)
2017-08-10 01:04:06
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列属于未来新能源标准的的是
①天然气 ②煤 ③核能 ④石油 ⑤太阳能 ⑥生物质能 ⑦风能 ⑧氢能
A.①②③④
B.③④⑤⑥⑦⑧
C.③⑤⑥⑦⑧
D.⑤⑥⑦⑧
|
参考答案:D
本题解析:根据新能源标准,太阳能、生物质能、风能、氢能属于未来新能源,故D正确。
考点:本题考查化学与环境。
本题难度:一般
2、填空题 (8分)已知下列热化学方程式:①2H2(g) +O2(g)=2H2O(l);ΔH= -570 kJ·mol-1
②2H2(g) +O2(g)=2H2O(g) ΔH= -483.68 kJ·mol-1
③2C(s) +O2(g)=2CO(g) ΔH=-221 kJ·mol-1
④ C(s) +O2(g)=CO2(g) ΔH= -393.5 kJ·mol-1
回答下列问题:
(1)H2的燃烧热为 ;C的燃烧热为 。
(2)燃烧10gH2生成液态水,放出的热量为 。
(3)写出CO燃烧的热化学方程式 。
参考答案:(1)285KJ/mol、393.5KJ/mol (2)1425KJ
(3)CO(g) +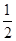 O2(g)=CO2(g);ΔH=-283KJ/mol O2(g)=CO2(g);ΔH=-283KJ/mol
本题解析:(1)燃烧热是在一定条件下,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量。所以氢气的燃烧热是285KJ/mol。C的燃烧热为393.5KJ/mol。
(2)10g氢气是5mol,放出的热量是285KJ/mol×5mol=1425KJ。
(3)④×2-③得到2CO(g) +O2(g)=2CO2(g) ΔH= -566 kJ·mol-1 。
本题难度:一般
3、填空题 以下各题中各量的关系,请用“﹥”、“=”或“﹤”表示。
(1)pH = 3的醋酸和pH=11的氢氧化钠溶液等体积混合,混合液中c(Na+) ?c(CH3COO-)
(2)等物质的量浓度、等体积盐酸和醋酸钠混合,混合液中各离子浓度的大小关系为?
?
(3)常温下,若NaOH溶液中的c(OH-)与NH4Cl溶液中的c(H+)相同。现将NaOH和NH4Cl的溶液分别稀释10倍,稀释后NaOH和NH4Cl溶液的pH分别用pH1和pH2表示。则pH1+ pH2??14
(4)现有pH相等、等体积的Ba(OH)2、NaOH和NH3·H2O三种溶液,将它们分别与V1 L、V2 L、V3 L等浓度的盐酸混合,混合后溶液均呈中性,则V1 、V2 、V3的大小关系?
参考答案:(1)c(Na+)﹤? c(CH3COO-)(2) c(Cl-)=c(Na+)﹥c(H+)﹥c(CH3COO-)﹥c(OH-)?
(3)pH1+ pH2?﹤? 14 (4)V1、V2、V3的大小关系? V3﹥ V1 =V2
本题解析:(1)pH相同的弱酸与强碱等体积混合,溶液最终显酸性,c(H+)> c(OH—),由电荷守恒知另两离子浓度必然是:c(Na+)﹤?c(CH3COO-)
(2)等物质的量浓度、等体积盐酸和醋酸钠混合后即是等浓度的NaCl和CH3COOH溶液,NaCl全部电离,CH3COOH部分电离,溶液显酸性。
即:c(Cl- )=c(Na+)﹥c(H+)﹥c(CH3COO-)﹥c(OH-)
(3)可以用假设法更直接。假设NaOH溶液的pH为11、NH4Cl溶液的pH则为3,
如果同时稀释10倍,则NaOH溶液的pH为12,而NH4Cl溶液由于有水解平衡的存在,其pH则就略小于4,故pH1+ pH2?﹤?14
(4)两强碱溶液中OH—浓度相同,必然消耗相同的酸,故V1 =V2,?而弱碱里面存有电离平衡,必然要消耗更多的酸,所以V3﹥ V1 =V2
本题难度:一般
4、填空题 A、B、C三种一元弱酸的浓度均为0.1 mol·L-1,在室温下,A溶液中C(OH-)=7.6×10-12 mol·L-1,B溶液中水电离产生的H+浓度为10-10 mol·L-1,C溶液的pH=3,则三种溶液的酸性由强到弱的顺序是______________________________。
参考答案:A>C>B
本题解析:A溶液中c(H+)=1.3×10-3 mol·L-1,B溶液中c(OH-)=10-10 mol·L-1,c(H+)=10-4 mol·L-1,C溶液中c(H+)=10-3 mol·L-1,因A、B、C浓度相同,电离产生的c(H+)越大,酸越强。
本题难度:简单
5、选择题 常温下,下列有关溶液的说法不正确的是
A.某物质的水溶液中由水电离出的c(H+)=1×10-a mol/L,若a>7,则该溶液的pH为a或14-a
B.将0.2 mol/L的某一元弱酸HA溶液和0.1mol/L NaOH溶液等体积混合后溶液中存在:2c(OH-)+ c(A-)=2c(H+)+c(HA)
C.pH=3的二元弱酸H2R溶液与 pH=11的NaOH溶液混合后,混合液的pH等于7,则混合液中c(R2-) > c(Na+) > c(HR-)
D.相同温度下,0.2mol/L的醋酸溶液与0.1mol/L的醋酸溶液中c(H+)之比小于2:1
参考答案:C
本题解析:
分析:A、酸或碱溶液能抑制水的电离.
B、根据溶液的酸碱性、溶液呈电中性、电离和水解的关系等分析各种离子浓度的关系.
C、根据电荷守恒和物料守恒判断离子浓度之间的关系.
D、相同温度下,弱电解质溶液的浓度越大其电离程度越小.
解:A、某物质的水溶液中由水电离出的c(H+)=1×1b-amol/L,若a>7,说明该溶液能抑制水的电离,可能是酸溶液或碱溶液,所以该溶液的PH值为a或14-a,故A正确.
B、pH=多的6元弱酸H2R溶液与 pH=11的NaOH溶液混合后,混合液的pH等于7,说明溶液中阴阳离子所带电荷相等,因为弱根离子能水解导致溶液中钠离子浓度大于c(R2-)的2倍,水解程度是微弱的,所以c(R2-)>c(HR-).所以离子浓度大小顺序是c(Na+)>c(R2-)>c(HR-),故B错误.
C、将b.2 mol/L的某一元弱酸HA溶液和b.1mol/L NaOH溶液等体积混合后,溶液中盐和酸的浓度都是b.b左mol/L,根据电荷相等有c(OH-)+c(A-)=c(H+)+c(Na+),根据物料守恒得c(A-)+c(HA)=2c(Na+),所以得2c(OH-)+c(A-)=2c(H+)+c(HA),故C正确.
D、相同温度手,当b.2mol/L的醋酸溶液与b.1mol/L的醋酸溶液电离度相等时,其氢离子浓度之比为2:1,但实际上
弱电解质溶液的浓度越大其电离程度越小,所以b.2mol/L的醋酸溶液与b.1mol/L的醋酸溶液中氢离子浓度小于2:1,故D正确.
故选B.
本题难度:一般
|