微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知存在反应:X(g)+2Y(g) 2Z(g)。现将X和Y按体积比1∶2混合于一密闭容器中,并加压到3×107 Pa时达到平衡状态。此时反应物、生成物的物质的量之比为6∶1,则此时对应于图28中的温度应为(?)
2Z(g)。现将X和Y按体积比1∶2混合于一密闭容器中,并加压到3×107 Pa时达到平衡状态。此时反应物、生成物的物质的量之比为6∶1,则此时对应于图28中的温度应为(?)
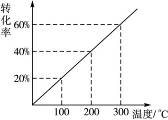
图2-8
A.100 ℃
B.200 ℃
C.300 ℃
D.400 ℃
参考答案:A
本题解析:本题目通过求出X或Y的转化率,然后查图象就可以确定其相应温度。
X(g)? +? 2Y(g) 2Z(g)
2Z(g)
起始? 1? 2? 0
转化? x? 2x? 2x
平衡? 1-x? 2-2x? 2x
所以有 ,x=0.2。
,x=0.2。
故X或Y的转化率均为20%,对应温度为100 ℃。
本题难度:简单
2、选择题 CO2和H2的混合气体加热到850 ℃时,可建立下列平衡:CO2 + H2 CO + H2O 在一定温度下,平衡有90%的H2变成了H2O,且c(CO2)c(H2)=c(CO)c(H2O),则原混合气中CO2和H2的分子数之比是
CO + H2O 在一定温度下,平衡有90%的H2变成了H2O,且c(CO2)c(H2)=c(CO)c(H2O),则原混合气中CO2和H2的分子数之比是
A.1∶1
B.1∶5
C.9∶1
D.1∶10
参考答案:C
本题解析:略
本题难度:简单
3、计算题 加热N2O5,依次发生的分解反应为①N2O5(g) N2O3(g)+O2(g),②N2O3(g)
N2O3(g)+O2(g),②N2O3(g) N2O(g)+O2(g),在1 L密闭容器中充入4 mol N2O5,加热到t ℃,达到平衡状态后O2的平衡浓度为4.5 mol·L-1,N2O3的平衡浓度为1.62 mol·L-1,求N2O5和N2O的平衡浓度。
N2O(g)+O2(g),在1 L密闭容器中充入4 mol N2O5,加热到t ℃,达到平衡状态后O2的平衡浓度为4.5 mol·L-1,N2O3的平衡浓度为1.62 mol·L-1,求N2O5和N2O的平衡浓度。
参考答案:N2O5的平衡浓度为0.94 mol·L-1,N2O的平衡浓度为1.44 mol·L-1
本题解析:题设中有两个反应,可理解为先发生反应①,其中生成的N2O3有一部分再发生分解反应②,且在两个反应中都有O2生成,再由已知条件列方程组求解。
设反应①中生成N2O3物质的量浓度为x,反应②中生成N2O物质的量浓度为y。则:
N2O5(g) N2O3(g)+O2(g)
N2O3(g)+O2(g)
起始浓度/mol·L-1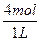 ?0? 0
?0? 0
转化浓度/mol·L-1x? x? x
N2O3(g) N2O(g)+O2(g)
N2O(g)+O2(g)
起始浓度/mol·L-1?x? 0? 0
转化浓度/mol·L-1? y? y?y
平衡浓度/mol·L-1? x-y? y? y
依题意O2的平衡浓度为x+y="4.5" mol·L-1
N2O3的平衡浓度为x-y="1.62" mol·L-1
解得? x="3.06" mol·L-1? y="1.44" mol·L-1
N2O5的平衡浓度为:4 mol·L-1-3.06 mol·L-1="0.94" mol·L-1
N2O的平衡浓度为:1.44 mol·L-1
本题难度:简单
4、选择题 在容积一定的密闭容器中发生可逆反应A(g)+2B(g) 2C(g) ΔH>0;平衡移动关系如图所示。下列说法正确的是( )
2C(g) ΔH>0;平衡移动关系如图所示。下列说法正确的是( )
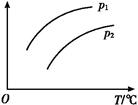
A.p1<p2,纵坐标指A的质量分数
B.p1>p2,纵坐标指C的质量分数
C.p1<p2,纵坐标指A的转化率
D.p1<p2,纵坐标指混合气体的平均摩尔质量
参考答案:B
本题解析:因为正反应是吸热的、体积减小的可逆反应,根据图像可知,随着温度的升高,纵坐标表示的量是逐渐增大的,由于升高温度,平衡向正反应方向移动,所以A不正确。当温度相同时,压强越大,平衡越有利于向正反应方向移动,所以根据图像可知,B正确,C、D都是错误的,答案选B。
本题难度:一般
5、填空题 在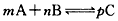 的反应中,经过10 s的反应后,各物质的浓度变化为:A减少a mol/L,B减少a/2
的反应中,经过10 s的反应后,各物质的浓度变化为:A减少a mol/L,B减少a/2
mol/L,C 增加a mol/L,则该反应的化学方程式是_______________________
参考答案: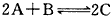
本题解析:
本题难度:一般