微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 化合物HIn在水溶液中因存在以下电离平衡,故可用作酸碱指示剂
HIn(aq)? ?H+(aq) + In-(aq)
?H+(aq) + In-(aq)
红色?黄色?
浓度为0.02 mol·L-1的下列各溶液:
①盐酸 ②石灰水? ③NaCl溶液? ④NaHSO4溶液?
⑤NaHCO3溶液? ⑥氨水,
其中能使指示剂显红色的是
A.①④
B.②⑤⑥
C.①④⑤
D.②③⑥
参考答案:A
本题解析:此题考查电离平衡:若使指示剂显红色,则HIn分子的成分应增多,In-应减少,故应使该弱电解质的电离平衡向左移动,主要应考虑通过增大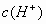 来实现,在所给出的各物质中,能使
来实现,在所给出的各物质中,能使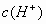 增大的只有盐酸和
增大的只有盐酸和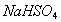 。
。
本题难度:简单
2、选择题 一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇,
(催化剂为Cu2O/ZnO):CO(g)+2H2(g)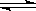 CH3OH(g),甲醇的物质的量与温度的关系如下图所示,下列分析正确的是?(?)?
CH3OH(g),甲醇的物质的量与温度的关系如下图所示,下列分析正确的是?(?)?

A.反应达到平衡时,平衡常数表达式 K=c(CH3OH)/c(CO)·c2(H2)
B.升高温度,K值增大
C.在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)=3tB /2nB mol·(L·min)-1
D.其他条件不变,E点的体积压缩到原来的1/2,重新平衡时n(H2)/n(CH3OH)增大
参考答案:A
本题解析:略
本题难度:简单
3、选择题 在一定温度下,向体积恒定为2L的密闭容器里充入2mol M和一定量的N,发生如下反应:
M(g)+N(g)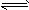 E(g);当反应进行到4min时达到平衡,此时测知M的浓度为0.2mol·L-1。下列说法正确的是
E(g);当反应进行到4min时达到平衡,此时测知M的浓度为0.2mol·L-1。下列说法正确的是
[? ]
A.4min时,M的转化率为80%
B.4min时,用M表示的反应速率为0.8mol·L-1·min-1
C.4min后,向容器中充入不参与反应的稀有气体,M的物质的量减小
D.2min时,M的物质的量浓度为0.6mol·L-1
参考答案:A
本题解析:
本题难度:一般
4、选择题 在一定温度下,在恒容的密闭容器中进行的可逆反应A(g)+3B(g) 2C(g)达到平衡的标志是( )
2C(g)达到平衡的标志是( )
A.C生成的速率和C分解的速率相等
B.单位时间内生成n mol A,同时生成3n mol B
C.B的消耗速率与C的消耗速率之比为1∶1
D.混合气体密度保持不变
参考答案:A
本题解析:A选项是由同种物质的两种速率来判断平衡,因此A对;B与C是由不同反应物的速率表示,而B表示的速率方向一致,所以不对;C表示的速率方向相反,但速率之比不等于计量数之比,所以B、C均不对;反应若是恒容条件下,由于反应物和生成物均为气体,混合气体密度始终保持不变,故D错误。
本题难度:一般
5、填空题 (15分)(一)一定温度下,在体积固定的密闭中加入2 mol X和1 mol Y,发生如下反应:2X(g) + Y(g) 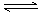 ?a Z(g) + W(g)?△H =-QkJ·mol-1 (Q>0)
?a Z(g) + W(g)?△H =-QkJ·mol-1 (Q>0)
当反应达到平衡后,反应放出的热量为Q1 kJ,物质X的转化率为α;平衡后再升高温度,混合气体的平均相对分子质量减小,则
(1)温度升高,平衡常数K的值将?(填“增大”.“减小”或“不变”)。
(2)化学计量数a的值为?,该反应的熵变△S ?0(填“>”.“<”或“=”)。
(3)平衡后,若压缩容器体积,则再达到平衡后X的浓度将________(填“增大”、“减少”或“不变”)? X的转化率α= ??(用含Q.Q1的代数式表示)。
(4)维持温度不变,若起始时向容器中加入的物质的量如下列各项,则反应达到平衡后放出的热量仍为Q1?kJ的是?(稀有气体不参与反应)。
A.2 molX.1mol Y.1molAr
B.a molZ.1mol W
C.1 molX.0.5mol Y.0.5a molZ.0.5 mol W
D.4 molX.2mol Y

