微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 将铝制品与另一种材料作电极,以某种溶液作电解液进行电解,通电后在铝制品与电解液的接触面上逐渐形成一层Al(OH)3薄膜,薄膜的某些部位存在着小孔,电流从小孔通过并产生热量使Al(OH)3分解,从而在铝制品表面形成一层较厚的氧化膜。某校研究性学习小组根据上述原理,以铝制品和铁棒为电极,一定浓度的NaHCO3溶液为电解液进行实验。
(1)铝制品表面形成氢氧化铝薄膜的电极反应式为______________________。
(2)电解过程中,必须使电解液的pH保持相对稳定(不能太大,也不能太小)的原因是______________
______________。
(3)使用NaHCO3溶液为电解液,会减缓阴极区溶液pH值的增大,能说明这一原理的离子方程式为
_______________________。
参考答案:(1)Al-3e-+3HCO3-==Al(OH)3↓+3CO2↑
(2)Al(OH)3和Al2O3都是两性物质,当电解液呈酸性或强碱性时,刚形成的Al2O3薄膜会被电解液溶解
(3)HCO3-+OH-==CO32-+H2O
本题解析:
本题难度:困难
2、选择题 下列叙述中,正确的是
A.在船舶的外壳装上铜块可防止其发生电化学腐蚀
B.MnO2、FeCl3和CuSO4都可加快H2O2的分解速率
C.FeCl3溶 液和Fe2(SO4)3溶液加热蒸干、灼烧都得到Fe2O3
液和Fe2(SO4)3溶液加热蒸干、灼烧都得到Fe2O3
D.用惰性电极分别电解CuCl2溶液和MgCl2溶液分别得到单质Cu和Mg
参考答案:B
本题解析:A:在船舶的外壳装上铜块是加快了船体的腐蚀,因为船体是铁,与铜形成原电池时铁做负极,腐蚀更快,为防止其发生电化学腐蚀可加一块比铁活泼的金属,如锌,船体做正极,就被保护了。C:FeCl3溶液溶液加热蒸干、灼烧得到Fe2O3,因为FeCl3水解得到HCl,挥发了,促进水解的进行。Fe2(SO4)3溶液加热蒸干时,水解产物是硫酸,无挥发性,最后产物还是Fe2(SO4)3。
D:用惰性电极分别电解CuCl2溶液时,得到单质Cu,电解MgCl2溶液时,得不到单质Mg,因为氧化性H+>Mg2+,H+先放电,得到H2。
本题难度:一般
3、选择题 能够实现反应Cu+2H2O===Cu(OH)2↓+H2↑的是
[? ]
A.铜银合金在潮湿空气中发生电化学腐蚀
B.用铜片作阴极、石墨作阳极,电解饱和氯化钠溶液
C.用铜片作阳极、石墨作阴极,电解饱和氯化钠溶液
D.铜片作原电池的负极,石墨作原电池的正极,氯化钠溶液作电解质溶液
参考答案:C
本题解析:
本题难度:一般
4、填空题 (每空2分,共10分)
研究CO2的利用对促进低碳社会的构建具有重要意义。
(1)将CO2与焦炭作用生成CO,CO可用于炼铁等。
已知:Fe2O3(s) + 3C(石墨) =" 2Fe(s)" + 3CO(g) △H 1 =" +489.0" kJ·mol-1
C(石墨) +CO2(g) = 2CO(g) △H 2 =" +172.5" kJ·mol-1
则CO还原Fe2O3(s)的热化学方程式为 。
(2)二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为:
CO2(g) +3H2(g) CH3OH(g) +H2O(g) △H
CH3OH(g) +H2O(g) △H
①该反应的平衡常数表达式为K= 。
②取一定体积CO2和H2的混合气体(物质的量之比为1∶3),加入恒容密闭容器中,发生上述反应。反应经过相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系如图1所示,则该反应的ΔH 0(填“>”、“<”或“=”)。
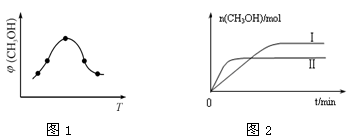
③在两种不同温度下发生反应,测得CH3OH的物质的量随时间变化如图2所示,曲线I、Ⅱ对应的平衡常数大小关系为KⅠ KⅡ(填“>”、“<”或“=”)。
④用硫酸溶液作电解质进行电解,CO2在电极上可转化为甲烷,该电极反应的方程式为 。
参考答案:(1)Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H=-28.5kJ/mol
(2)①c(CH3OH)×c(H2O)/c(CO2)×c(H2)3 ②< ③>
④CO2+8e-+8H+=CH4+2H2O
本题解析:(1)根据盖斯定律,将一式将去二式乘以2可得所求方程式,所以CO还原氧化铁的反应热△H=△H 1 -3△H 2=-28.5kJ/mol,热化学方程式为Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H=-28.5kJ/mol
(2)①根据平衡常数的定义可得,该反应的平衡常数表达式为K= c(CH3OH)×c(H2O)/c(CO2)×c(H2)3
②反应达到平衡时,甲醇的体积分数最大,再升高温度,甲醇的体积分数降低,说明升高温度,平衡逆向移动,所以正向是放热反应,△H<0;
③曲线II先出现拐点,说明II的温度高于I,因为温度升高,平衡逆向移动,所以甲醇的物质的量减少,温度升高,平衡常数减小,所以KⅠ> KⅠI;
④二氧化碳中C元素的化合价是+4价,甲烷中C元素的化合价是-4价,所以二氧化碳转化为甲烷得到8个电子,与氢离子结合生成甲烷与水,电极反应式为CO2-8e-+8H+=CH4+2H2O。
考点:考查盖斯定律的应用,化学反应与能量关系的判断,化学平衡移动的判断,电极反应式的书写
本题难度:困难
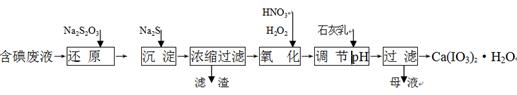
5、填空题 工业上利用含有一定浓度的I2和CuSO4溶液的工业废水制备饲料添加剂Ca(IO3)2,其生产流程如下:
已知:Ca(IO3)2微溶于水,溶于硝酸;Ksp(CuI)=1.1×10-12, Ksp(Cu2S)=2.5×10-48;
氧化性: HNO3>IO3—>H2O2
(1)“还原”过程中主要反应的化学方程式为:2Na2S2O3+I2 = + 2NaI。
(2)在还原过程还伴随有CuI生成,写出加入Na2S的离子反应方程式 。
(3)在氧化过程中先加入H2O2再加入浓硝酸,而不直接加入浓硝酸的目的是 。
(4)加入的石灰乳在溶液中反应而得到Ca(IO3)2,则要调节pH至 (填“酸性” 或“中性”或“碱性”),原因是 。
(5)Ca(IO3)2也可用电化学氧化法制取:先充分电解KI溶液,然后在电解后的溶液中加入CaCl2,最后过滤得到Ca(IO3)2。写出电解时阳极发生的电极反应方程式 ,用该方法制取Ca(IO3)2,每1kg碘化钾理论上可生产纯度为97.8%Ca(IO3)2的质量为 ____kg(计算结果保留3位有效数字)。
参考答案:(1) Na2S4O6 (2分)
(2)2CuI(s)+S2—=Cu2S(s)+2I— (3分)
(3)减少氧化过程中生成的氮的氧化物的污染 (2分)
(4)中性 (2分)Ca(IO3)2在硝酸溶液中溶解,故要中和过量的酸;在碱性溶液中,会混有微溶的Ca(OH)2造成产品不纯。 (2分)
(5)3H2O+I— -6e—=IO3—+6H+ (3分) ; 1.20(2分)
本题解析: (1)该过程称之为还原过程,可以肯定发生了氧化还原反应,所以根据方程式中的I的化合价降低可以知道,Na2S2O3 的中S的化合价升高,再根据Na、O原子守恒可以配平该方程式为2Na2S2O3+I2 = Na2S4O6+ 2NaI,还可以根据写出的化学方程式用电子得失配平验证。此处的难点关键在于缺项物质为中学阶段没接触过的连四硫酸钠,所以可能会出现想不到或是不敢写的情况,只要大胆利用所学的原则配平就可以了。
(2)还原过程中已经说明有沉淀CuI生成了,所以加入Na2S还会发生反应,则应该是通过已知条件中的沉淀溶解平衡常数进行比较得出结论,比较之下Cu2S比 CuI更加难溶,所以此时会发生沉淀转化,所以发生的反应方程式书写要按照沉淀溶解平衡的格式书写,方程式为2CuI(s)+S2—(aq)=Cu2S(s)+2I—(aq)。
(3)氧化步骤加入的H2O2 和浓硝酸起到氧化的目的,但是浓硝酸参与的反应容易产生氮氧化物污染环境,所以先加入过氧化氢。由于氧化性顺序HNO3>IO3—>H2O2 ,所以加入的过氧化氢只能把I-氧化为IO3- ,要使I2继续被氧化为IO3- ,还需要再加入浓硝酸,使浓硝酸反应更加完全,从而减少过程中氮氧化物的污染。
(4)加入石灰乳目的是反应得到Ca(IO3)2 ,且通过操作可以看出反应后要使Ca(IO3)2 尽可能多得以晶体形式析出,而Ca(IO3)2溶于硝酸,所以必须调节pH值把过量的硝酸中和掉,且加入的石灰乳不能过量,过量则会混入石灰乳沉淀杂质,所以应该调节pH至中性。
(5)用KI溶液电解制备Ca(IO3)2 溶液,则I-需要发生氧化反应在阳极放电生成IO3-,电解液是非碱性的,所以根据O原子守恒,IO3—中的O一定来源于H2O中,从而生成了H+,所以电极反应式为:3H2O+I— -6e—=IO3—+6H+ ;计算碘化钾的质量可以采用I原子守恒计算,所以有1/2n(KI)= n(Ca(IO3)2)=1000/166mol,m产品=M(Ca(IO3)2)×n(Ca(IO3)2)÷97.8%=390g/mol×1000/166mol÷97.8%≈1200g=1.20kg。
考点:本题考查的是化学工艺流程,涉及到了陌生的氧化还原反应缺项配平、沉淀转化、环境问题、PH调节、电化学基础、转化计算等内容。
本题难度:困难