微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 (19分)钒有金属“维生素”之称,研究发现钒的某些化合物对治疗糖尿病有很好的疗效。
工业上设计将VOSO4中的K2SO4、SiO2、CuO杂质除去并回收得到V2O5的流程如下:
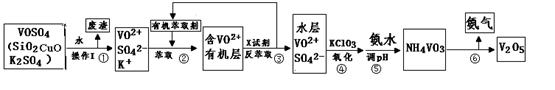
请回答下列问题:
(1)步骤②、③的变化过程可表示为(HM为有机萃取剂):
VOSO4 (水层)+ 2HM(有机层)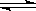 VOM2(有机层) + H2SO4 (水层)
VOM2(有机层) + H2SO4 (水层)
步骤②中萃取时必须加入适量碱,其原因是 。
步骤③中X试剂为 。
(2)步骤④的离子方程式为
(3)该工艺流程中,可以循环利用的物质有 和 。
(4)操作Ⅰ得到的废渣,用 溶解,充分反应后, ,(填写系列操作名称)称量得到mg氧化铜。
(5)为了制得氨水,甲、乙两小组选择了不同方法制取氨气,请将实验装置的字母编号和制备原理填写在下表空格中。
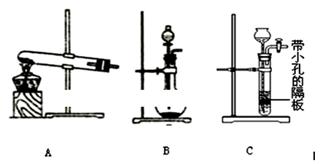
| 实验装置
| 实验药品
| 制备原理
|
甲小组
| A
| 氢氧化钙、氯化铵
| 反应的化学方程式为①
|
乙小组
| ②
| 浓氨水、氢氧化钠固体
| 分析产生氨气的原因③
|
参考答案:(1)加入碱中和硫酸,促使平衡正向移动,提高钒的萃取率(2分);H2SO4(2分)
(2)ClO3-+6VO2++9H2O= Cl-+6VO3-+18H+(3分)
(3)氨气(或氨水)(1分);有机萃取剂(1分)
(4) 氢氧化钠溶液(1分) 过滤、洗涤、干燥(2分)
(5)① 2NH4Cl+Ca(OH)2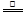 CaCl2+2H2O+2NH3↑。(2分)② B (2分)
CaCl2+2H2O+2NH3↑。(2分)② B (2分)
③氢氧化钠溶于水放出大量热,温度升高,使氨的溶解度减小而放出;氧氧化钠吸水,促使氨放出;氢氧化钠电离出的OH-增大了氨水中OH-浓度,促使氨水电离平衡左移,导致氨气放出。 (3分)
本题解析:(1)根据题意知,步骤②、③的变化过程可表示为(HM为有机萃取剂):
VOSO4 (水层)+ 2HM(有机层)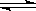 VOM2(有机层) + H2SO4 (水层) ,萃取过程该平衡正向移动,反萃取过程该平衡逆向移动;步骤②中萃取时必须加入适量碱,其原因是加入碱中和硫酸,促使平衡正向移动,提高钒的萃取率。步骤③中X试剂为H2SO4。(2)根据题给流程图知,步骤④为ClO3-将6VO2+氧化为VO3-,根据氧化还原方程式及离子方程式的书写原则写出该反应的离子方程式为ClO3-+6VO2++9H2O= Cl-+6VO3-+18H+。(3)由题给工艺流程知,可以循环利用的物质有氨气(或氨水)和有机萃取剂。(4)操作Ⅰ为溶解操作,二氧化硅和氧化铜不溶于水,得到的废渣为二氧化硅和氧化铜的混合物,二氧化硅为酸性氧化物,氧化铜为碱性氧化物,故用氢氧化钠溶液溶解,充分反应后,过滤、洗涤、干燥,称量得到mg氧化铜。(5)甲小组为氢氧化钙和氯化铵固体共热生成氯化钙、氨气和水,化学方程式为2NH4Cl+Ca(OH)2
VOM2(有机层) + H2SO4 (水层) ,萃取过程该平衡正向移动,反萃取过程该平衡逆向移动;步骤②中萃取时必须加入适量碱,其原因是加入碱中和硫酸,促使平衡正向移动,提高钒的萃取率。步骤③中X试剂为H2SO4。(2)根据题给流程图知,步骤④为ClO3-将6VO2+氧化为VO3-,根据氧化还原方程式及离子方程式的书写原则写出该反应的离子方程式为ClO3-+6VO2++9H2O= Cl-+6VO3-+18H+。(3)由题给工艺流程知,可以循环利用的物质有氨气(或氨水)和有机萃取剂。(4)操作Ⅰ为溶解操作,二氧化硅和氧化铜不溶于水,得到的废渣为二氧化硅和氧化铜的混合物,二氧化硅为酸性氧化物,氧化铜为碱性氧化物,故用氢氧化钠溶液溶解,充分反应后,过滤、洗涤、干燥,称量得到mg氧化铜。(5)甲小组为氢氧化钙和氯化铵固体共热生成氯化钙、氨气和水,化学方程式为2NH4Cl+Ca(OH)2 CaCl2+2H2O+2NH3↑;乙小组用浓氨水和氢氧化钠固体不加热制氨气,应选B装置;产生氨气的原因为氢氧化钠溶于水放出大量热,温度升高,使氨的溶解度减小而放出;氧氧化钠吸水,促使氨放出;氢氧化钠电离出的OH-增大了氨水中OH-浓度,促使氨水电离平衡左移,导致氨气放出。
CaCl2+2H2O+2NH3↑;乙小组用浓氨水和氢氧化钠固体不加热制氨气,应选B装置;产生氨气的原因为氢氧化钠溶于水放出大量热,温度升高,使氨的溶解度减小而放出;氧氧化钠吸水,促使氨放出;氢氧化钠电离出的OH-增大了氨水中OH-浓度,促使氨水电离平衡左移,导致氨气放出。
考点:以工业上将VOSO4中的K2SO4、SiO2、CuO杂质除去并回收得到V2O5的流程为载体考查化学平衡移动原理、物质的分离和提纯、氨气的制备及相关反应方程式的书写。
本题难度:一般
2、选择题 (双选)下列图示与对应的叙述不相符的是( ? )
A.图1表示相同温度下,向pH=10的氢氧化钠溶液和氨水中分别加水稀释时pH的变化曲线,其中b表示氨水稀释时pH的变化曲线
B.图2表示向含有少量氢氧化钠的偏铝酸钠溶液中滴加盐酸所得沉淀物质的量与盐酸体积的关系
C.图3表示压强对可逆反应CO(g)+H2O(g)?CO2(g)+H2(g)的影响,乙的压强比甲的压强大
D.图4表示10?mL?0.01?mol?L-1?KMnO4?酸性溶液与过量的0.1?mol?L-1?H2C2O4溶液混合时,n(Mn2+)?随时间的变化(Mn2+对该反应有催化作用)
参考答案:AB
本题解析:
本题难度:简单
3、选择题 已知反应:A(g)+3B(g) 2C(g),
2C(g), 。在容积为1L的固定体积的容器中充入1molA、3molB,各物质浓度随时间变化的曲线如图所示,下列说法错误的是( )
。在容积为1L的固定体积的容器中充入1molA、3molB,各物质浓度随时间变化的曲线如图所示,下列说法错误的是( )
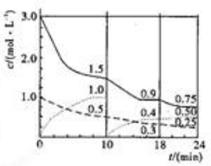
A.第18-24分钟用B物质表示的反应速率为0.025mol·L-1·min-1
B.容器中气体的平均摩尔质量不再发生变化时反应达到了平衡状态
C.前10分钟内反应放出的热量为Q/2kJ
D.第18分钟时改变的条件是增大了压强
参考答案:D
本题解析:第18至24分钟B物质反应减小的浓度是0.15mol·L-1,故B物质的反应速率为0.025mol·L-1·min-1,A正确;B 、因此反应是反应前后气体体积变化的反应,故容器中气体的平均摩尔质量不再发生变化时说明了反应达到了化学平衡状态,正确;也正确;前10分钟内A、B分别反应了0.5mol、1.5mol,反应放出的热量为Q/2kJ,C正确;第18分钟时改变的条件若是增大了压强则各物质的浓度有突变,图像不符合,D错误。
考点:化学反应速率和化学平衡
本题难度:一般
4、选择题 T℃时,在2L的密闭容器中,A气体与B气体发生可逆反应生成C气体,反应过程中A、B、C物质的量变化如图(Ⅰ)所示.若保持其它条件不变,温度分别为T1和T2时,B的物质的量分数与时间关系如图(Ⅱ)所示.下列叙述正确的是( )

A.2?min内A的化学反应速率为0.1?mol/(L?min)
B.在反应达平衡时,保持其他条件不变,增大压强,正逆反应速率都增大,且平衡向逆反应方向移动
C.在反应达平衡时,其它条件不变,升高温度,正逆反应速率都增大,且A的转化率增大
D.在T℃时,若A的浓度减少了1?mol/L,则B的浓度会减少3?mol/L,C的浓度会增加2?mol/L
参考答案:D
本题解析:
本题难度:简单
5、填空题 (8分)元素周期表中第ⅦA族元素的单质及其化合物的用途广泛。
(1)Cl2的电子式是 。新制的氯水可用于漂白,工业上将氯气制成漂白粉的目的是 ,漂白粉是一种 (填“混合物”或“纯净物”)。
(2)碘元素在元素周期表中的位置是 ;为防缺碘,食盐中常添加碘酸钾,该物质内存在 键(填化学键类型)。
(3)溴单质是唯一常温下呈液态的非金属单质,液溴的保存通常采取的方法是 。
(4)已知:X2(g)+H2(g)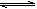 2HX(g) (X2表示Cl2、Br2和I2)。下图表示平衡常数K与温度T的关系。
2HX(g) (X2表示Cl2、Br2和I2)。下图表示平衡常数K与温度T的关系。
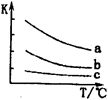
① H表示X2与H2反应的晗变,?H 0。(填“>”、“<”或“=”)
H表示X2与H2反应的晗变,?H 0。(填“>”、“<”或“=”)
②曲线a表示的是 (填“Cl2”、“Br2”或“I2”)与H2反应时K与T的关系。
参考答案:(8分)
(1)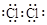 漂白粉比次氯酸稳定,便于储存和运输。 混合物
漂白粉比次氯酸稳定,便于储存和运输。 混合物
(2)第五周期ⅦA族 离子键、共价键
(3)水封在棕色瓶中,密闭保存
(4)①< ② Cl2
本题解析:(1)氯气是双原子分子,以共价键形成分子,则Cl2的电子式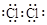 ,由于漂白粉比次氯酸稳定,便于储存和运输,工业上用氯气和石灰乳反应制漂白粉,漂白粉是CaCl2和Ca(ClO)2 的混合物。
,由于漂白粉比次氯酸稳定,便于储存和运输,工业上用氯气和石灰乳反应制漂白粉,漂白粉是CaCl2和Ca(ClO)2 的混合物。
(2)碘元素的原子有5层电子,最外层7个电子,所以碘元素在元素周期表中的位置是第五周期ⅦA族,为防缺碘,食盐中常添加碘酸钾,该物质属于含氧酸盐,所以分子内存在离子键和共价键。
(3)溴易挥发,液溴的保存通常采取的方法是水封在棕色瓶中,密闭保存。
(4)①根据图像可知,温度升高,K值减小,若?H表示X2与H2反应的晗变,则?H<0,②同主族元素,从上到下,非金属性减弱,反应生成HX的程度越来越小,K值越小,则曲线a表示的是Cl2与H2反应时K与T的关系。
考点:考查卤族元素单质及化合物的性质。
本题难度:困难