微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 已知铜在常温下能被稀硝酸溶解,反应方程式为:3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O
(1)用单线桥法标出电子得失的方向和数目______
(2)上述反应中氧化剂是______,氧化产物是______.没有参加氧化还原反应的硝酸占总硝酸的______.
参考答案:(1)化合价升高元素Cu失电子,化合价降低元素N得到电子,化合价升高数=化合价降低数=转移电子数=6,电子转移情况如下:
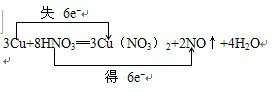
,故答案为:
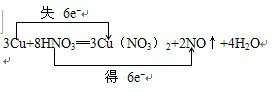
;
(2)化合价降低元素所在的反应物HNO3是氧化剂,化合价升高元素Cu所在的反应物是还原剂,对应产物Cu(NO3)2是氧化产物,在8mol的硝酸中,只有2mol做氧化剂,其余6mol做还原剂,没有参加氧化还原反应的硝酸占总硝酸的68,即34,故答案为:HNO3;Cu(NO3)2;34.
本题解析:
本题难度:简单
2、简答题 “比较”是化学研究的基本方法之一,请运用比较法解答下列问题:已知在一定条件下,过氧化钠几乎可与所有的常见气态非金属氧化物反应.
如:2Na2O+2CO2═2Na2CO3+O2,Na2O2+CO═Na2CO3
(1)试分别写出Na2O2与SO2、Na2O2与SO3(g)反应的化学方程式:______、______
(2)当1mol?SO3(g)参加反应时,转移电子的物质的量为______mol.
(3)通过比较可知:在氧化物中,当非金属元素处于______(填“最低”、“中间”或“最高”)价时,其氧化物与过氧化钠反应就有O2生成.
参考答案:(1)根据根据过氧化钠和二氧化碳的反应,可以推知过氧化钠和二氧化硫反应生成亚硫酸钠和氧气,亚硫酸钠易被氧气氧化为硫酸钠,即SO2+Na2O2=Na2SO4,三氧化硫和过氧化钠反应生成硫酸钠和氧气,
即2SO3+2Na2O2=2Na2SO4+O2,故答案为:2Na2O2+2SO2═2Na2SO4;2Na2O2+2SO3═2Na2SO4+O2;
(2)根据反应2Na2O2+2SO3═2Na2SO4+O2,该反应中化合价升高值=化合价降低值=2,即转移电子数为2,
所以当1mol?SO3(g)参加反应时,转移电子的物质的量为1mol,故答案为:1;
(3)根据反应2Na2O+2CO2═2Na2CO3+O2,Na2O2+CO═Na2CO3和2Na2O2+2SO2═2Na2SO4,2Na2O2+2SO3═2Na2SO4+O2,比较可知:在氧化物中,当非金属元素处于最高价时,其氧化物与过氧化钠反应就有O2生成,故答案为:最高.
本题解析:
本题难度:一般
3、选择题 在反应3S+6KOH=K2SO3+2K2S+3H2O?中,作还原剂和作氧化剂的硫原子个数比为( )
A.1:2
B.2:1
C.1:1
D.3:2
参考答案:在3S+6KOH=2K2S+K2SO3+3H2O反应中,硫元素化合价由0价升高为+4价,被氧化,氧化产物为K2SO3,硫元素由0价降低为-2价,被还原,还原产物为K2S,所以硫既作氧化剂又作还原剂,氧化剂被还原生成还原产物,还原剂被氧化生成氧化产物,根据还原产物与氧化产物的化学计量数可知;作还原剂的S原子与作氧化剂的S原子的物质的量之比为1:2;即作还原剂和作氧化剂的硫原子个数比为1:2,
故选A.
本题解析:
本题难度:一般
4、选择题 化学反应过程中总是伴随着能量的变化.下列反应既属于氧化还原反应,又属于吸热反应的是( )
A.镁条在空气中燃烧
B.Ba(OH)2?8H2O与NH4Cl反应
C.铝片与稀盐酸反应
D.灼热的炭与CO2的反应
参考答案:A、镁条在空气中燃烧的反应是氧化还原反应,又是放热反应,故A错误;
B、Ba(OH)2?8H2O与NH4Cl的反应属于吸热反应但是不是氧化还原反应,故B错误;
C、铝片与稀盐酸反应属于放热反应,也是氧化还原反应,故C错误;
D、甲灼热的炭与CO2的反应既属于氧化还原反应,又是吸热反应,故D正确.
故选D.
本题解析:
本题难度:简单
5、填空题 指出下列反应的氧化剂和还原剂? Zn+2HCl=ZnCl2+H2↑
氧化剂______?还原剂______.
参考答案:Zn+2HCl=ZnCl2+H2↑中,反应中氢元素化合价从+1价变化为0价,化合价降低得到电子,所以HCl做氧化剂,锌元素的化合价从 0价变化为+2价,元素化合价升高失电子,所以Zn做还原剂;
故答案为:HCl;Zn.
本题解析:
本题难度:一般