微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引用了各界的普遍重视。目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g)  CH3OH(g)+H2O(g),该反应的能量变化如图所示:
CH3OH(g)+H2O(g),该反应的能量变化如图所示:
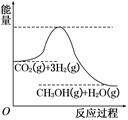
(1)上述反应平衡常数K的表达式为?,温度降低,平衡常数K?(填“增大”、“不变”或“减小”)。
(2)在体积为2 L的密闭容器中,充入1 mol CO2和3 mol H2,测得CO2的物质的量随时间变化如下表所示。从反应开始到5 min末,用氢气浓度变化表示的平均反应速率v(H2)=?。
t/min
| 0
| 2
| 5
| 10
| 15
|
n(CO2)/mol
| 1
| 0.75
| 0.5
| 0.25
| 0.25
|
?
(3)下列条件能使上述反应的反应速率增大,且平衡向正反应方向移动的是?(填写序号字母)
a.及时分离出CH3OH气体
b.适当升高温度
c.保持容器的容积不变,再充入1 mol CO2和3 mol? H2
d.选择高效催化剂
2、选择题 某温度下2L密闭容器中,3种气体起始状态和平衡状态时的物质的量(n)如表所示.下列说法正确的是( )
| ? | X | Y | W
(起始状态)/mol
2
1
0
(平衡状态)/mol
1
0.5
1.5
|
A.该温度下,此反应的平衡常数表达式是K=
B.升高温度,若W的体积分数减小,则此反应△H>0
C.增大压强,正、逆反应速率均增大,平衡向正反应方向移动
D.该温度下,再向容器中通入3molW,达到平衡时,n(X)=2mol
3、填空题 工业上利用反应:CO(g)+H2O(g) 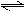 ?CO2(g)+H2(g);△H="Q" kJ·mol-1,制备H2 .已知该反应的平衡常数K与温度的关系如图所示。
?CO2(g)+H2(g);△H="Q" kJ·mol-1,制备H2 .已知该反应的平衡常数K与温度的关系如图所示。

若在一容积固定的密 闭容器中,于850℃时发生上述反应,并测得容器内各物质的浓度(mol·L―1)随时间的变化关系如下表:
闭容器中,于850℃时发生上述反应,并测得容器内各物质的浓度(mol·L―1)随时间的变化关系如下表:
t/min
| CO(g)
| H2O(g)
| CO2(g)
| H2(g)
|
0
| 0.200
| 0.300
| 0
| 0
|
2
| 0.138
| 0.238
| 0.062
| 0.062
|
3
| c1
| c2
| c3
| c4
|
4
| c1
| c2
| c3
| c4
|
?
已知:850℃时该反应的化学平衡常数K=1.0,请回答下列问题:
(1)下列可以判断该反应达到化学平衡状态的是_______.
A.单 位时间内减少CO(g)的浓度等于生成CO2(g)的浓度
位时间内减少CO(g)的浓度等于生成CO2(g)的浓度
B.反应容器内的压强不发生变化
C.混合气体中H2(g)的浓度不再发生改变
D.氢气的生成速率等于水的消耗速率
(2)Q______0(填“>”、“=”或“<”).
(3)若在850℃时向反应容器中充入H2O(g),K值___ __(填“增大”、“减小”或“不变”).
__(填“增大”、“减小”或“不变”).
(4)达平衡时CO2的反应速率______,CO(g)的转化率为_______.
4、选择题 某温度下,N2O4(g) 2 NO2(g);△H>0。在密闭容器中达到平衡,下列说法不正确的是?
2 NO2(g);△H>0。在密闭容器中达到平衡,下列说法不正确的是?
A.加压时(减小体积),将使正、逆反应速率增大,平衡向逆反应方向移动
B.保持体积不变,加入少许NO2,将使正反应速率减小,逆反应速率增大,平衡向逆反应方向动
C.保持体积不变,加入少许N2O4,再达到平衡时,颜色变深
D.保持体积不变,升高温度,再达平衡时颜色变深
5、计算题 在一定条件下,将一定量PCl5(g)通入密闭容器中,发生反应PCl5(g)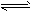 PCl3(g)+Cl2(g)。当达到平衡时,混合气体相对于H2的密度为74.5,则PCl3(g)在平衡混合气体中所占体积分数是?简述计算过程。
PCl3(g)+Cl2(g)。当达到平衡时,混合气体相对于H2的密度为74.5,则PCl3(g)在平衡混合气体中所占体积分数是?简述计算过程。