微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (13分)工业上生产高氯酸时,还同时生产了一种常见的重要含氯消毒剂和漂白剂
亚氯酸钠(NaClO2),其工艺流程如下:
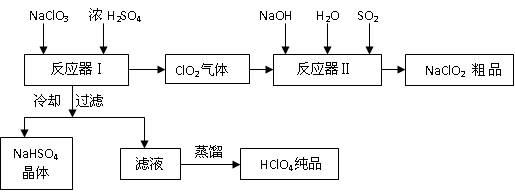
已知:
1.NaHSO4溶解度随温度的升高而增大,适当条件下可结晶析出。
2.高氯酸是至今为止人们已知酸中的最强酸,沸点90℃。
请回答下列问题
(1)反应器Ⅰ中发生反应的化学方程式为?,冷却的目的是??,能用蒸馏法分离出高氯酸的原因是??。
(2)反应器Ⅱ中发生反应的离子方程式为?。
(3)通入反应器Ⅱ中的SO2用另一物质H2O2代替同样能生成?NaClO2 ,请简要说明双氧水在反应中能代替SO2的原因是?
(4)Ca(ClO)2 、ClO2、NaClO、NaClO2 等含氯化合物都是常用的消毒剂和漂白剂是因为它们都具有?请写出工业上用氯气和NaOH溶液生产另一种消毒剂?NaClO的离子方程式?
参考答案:(13分)(1)3NaClO3+3H2SO4=HClO4+2ClO2+3NaHSO4+H2O;(2分)
降低NaHSO4的溶解度,使NaHSO4结晶析出(2分)高氯酸的沸点低(1分)
(2)2ClO2+SO2+4OH-=2ClO2-+SO42-+2H2O;(2分)
(3)H2O2有还原性也能把ClO2还原为NaClO2 (2分)
(4)强氧化性(2分)? Cl2 + 2OH-?=? ClO-?+ Cl-?+ H2O;(2分)
本题解析:(1)反应器Ⅰ中发生反应的化学方程式为:3NaClO3+3H2SO4=HClO4+2ClO2+3NaHSO4+H2O;冷却的目的是:降低NaHSO4的溶解度,使NaHSO4结晶析出;能用蒸馏法分离出高氯酸的原因是:高氯酸的沸点低。
(2)反应器Ⅱ中发生反应的离子方程式为:2ClO2+SO2+4OH-=2ClO2-+SO42-+2H2O;
(3)通入反应器Ⅱ中的SO2用另一物质H2O2代替同样能生成?NaClO2 ,双氧水在反应中能代替SO2的原因是:H2O2有还原性也能把ClO2还原为NaClO2 。
(4)Ca(ClO)2 、ClO2、NaClO、NaClO2 等含氯化合物都是常用的消毒剂和漂白剂是因为它们都具有强氧化性,用氯气和NaOH溶液生产另一种消毒剂?NaClO的离子方程式为:Cl2 + 2OH-?=? ClO-?+ Cl-?+ H2O
本题难度:简单
2、选择题 下列有关化学品的说法不正确的是
A.过氧乙酸是一种常见的消毒剂,在2003年抗击“非典”过程中发挥了巨大的作用
B.常见的染发剂有植物染发剂、无机染发剂、合成染发剂三大类
C.草木灰、尿素、敌敌畏、碳酸氢铵都是农业生产中常用的化肥
D.有机磷农药比有机氯农药易分解,在环境中残留时间短,所以目前被普遍使用
参考答案:C
本题解析:敌敌畏是杀虫剂,不是农药,C不正确,其余都是正确的,答案选C。
本题难度:简单
3、选择题 煤是一种重要的能源,含有硫元素,燃烧时会生成SO2。下列说法正确的是( )。
A.煤是含硫化合物
B.煤是一种可再生能源
C.在水吸收SO2的过程中只发生物理变化
D.SO2是酸性氧化物,被云雾吸收后可转化成酸雨
参考答案:D
本题解析:煤是由多种无机物和有机物组成的复杂的混合物,是一种不可再生的化石燃料,A、B错误。SO2是一种酸性氧化物,其溶于水中的部分SO2和H2O发生反应生成H2SO3,也可被云雾吸收形成酸雨,C错误。
本题难度:一般
4、选择题 下列叙述,正确的是
A.当前世界面临的三大环境问题指:温室效应、酸雨和光化学烟雾
B.白色污染就是指白色的垃圾产生的污染
C.纯碱、小苏打均可作为食品添加剂,但必须控制其含量
D.不慎误食BaCl2,可服用稀H2SO4解毒
参考答案:C
本题解析:
三大环境问题指:温室效应、酸雨和臭氧空洞,故A错;白色污染通常指塑料及塑料制品的污染,故B错;误食氯化钡可以用硫酸钠解毒, 但不能用稀H2SO4。用硫酸钠的原理就是硫酸钠和氯化钡反应会生成硫酸钡难溶,那就可以被直接排出体外了,钡离子也就出去了,故D错。纯碱、小苏打均可作为食品添加剂,因为它们受热后分解,产生二氧化碳,可以使食物发泡,蓬松,但必须控制其含量,故C正确。
本题难度:一般
5、选择题 自然环境与人们的生活息息相关。下列有关环境的说法不正确的是
A.氟利昂(CCl2F2)因破坏大气臭氧层,会导致“温室效应”
B.生活污水中所含的氮、磷化合物是植物营养素,但会导致水体污染
C.废旧电池的回收,其主要目的是为了保护环境,而不是回收金属
D.淀粉餐具被认为是最有发展前景的一次性餐具,可有利于保护环境
参考答案:A
本题解析:略
本题难度:简单