微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列反应中,不属于四种基本反应类型,但属于氧化还原反应的是
[? ]
A.2Na + 2H2O ==2NaOH + H2↑
B.CH4 + 2O2==CO2 + 2H2O
C.KClO3==2KCl + 3O2↑
D.CaCO3 + 2HCl == CaCl2 + H2O + CO2↑
参考答案:B
本题解析:
本题难度:简单
2、选择题 赤铜矿的主要成分是Cu2O,辉铜矿的主要成分是Cu2S,将赤铜矿与辉铜矿按一定比例混合加热可制得铜:2Cu2O+Cu2S  6Cu+SO2↑。对于该反应,下列说法中正确的是(?)
6Cu+SO2↑。对于该反应,下列说法中正确的是(?)
A.该反应中的氧化剂只有Cu2O
B.氧化产物和还原产物的物质的量之比为6:1
C.Cu既是氧化产物又是还原产物
D.Cu2S在反应中既是氧化剂又是还原剂
参考答案:D
本题解析:根据方程式可知,反应中铜元素的化合价均从+1价降低到0价,得到1个电子,被还原,发生还原反应,因此氧化亚铜和硫化亚铜都是氧化剂。S元素的化合价从-2价升高温度+4价,失去6个电子,被氧化,发生氧化反应,所以硫化亚铜还是还原剂,铜只是还原产物,A、C不正确,B不正确,氧化产物和还原产物的物质的量之比为1:6,答案选D。
点评:该题是高考中的常见题型,属于中等难度的试题。试题贴近高考,综合性强。侧重对学生分析、归纳、总结问题的能力的培养。该题的关键是准确判断出有关元素的化合价变化情况,然后结合有关的概念灵活运用、分析和判断即可。
本题难度:一般
3、选择题 下列叙述正确的是(?)
A.氧化还原反应的本质是元素化合价发生了改变
B.氧化还原反应中氧化剂发生了氧化反应
C.氧化剂在同一反应中既可以是反应物,也可以是生成物
D.有单质参加的化合反应一定是氧化还原反应
参考答案:D
本题解析:元素的化合价变化是氧化还原反应来源:91 考试网的特征,并不是其本质;氧化还原反应中氧化剂得电子,被还原;氧化剂一定是反应物,不可能是产物。
本题难度:简单
4、选择题 假设某化学反应的反应过程如下图所示
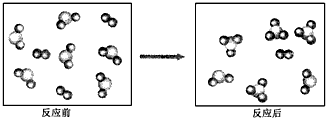
观察分析,符合图中变化的化学反应为
[? ]
A.A2+3B2 2AB3
2AB3
B.2AB2+B2 2AB3
2AB3
C.2A2B+5B2==4AB3
D.2AB2+B2==2AB3
参考答案:B
本题解析:
本题难度:一般
5、选择题 下列有关氧化还原反应的叙述正确的是( ?)
A.金属单质在反应中只作还原剂
B.非金属单质在反应中只作氧化剂
C.金属失电子越多,其还原性越强有力
D.Cu2+比Fe2+氧化性强,Fe比Cu还原性强
参考答案:AD
本题解析:A项中金属没有负化合价,所以单质只作还原剂;B项中非金属既有负价又有正价,可能用氧化剂,也可能作还原剂;C项中已在第3题中辨析过,不正确;D项实际上是一个经验规律:金属的还原性越强,其相应阳离子的氧化性越弱。
本题难度:简单