微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列工业生产过程中,不涉及氧化还原反应的是
A.用S制备H2SO4
B.炼铁时用CaO除去原料中的SiO2
C.将海水中的MgSO4转变为金属Mg
D.用NO2生产HNO3
参考答案:B
本题解析:氧化还原反应的特征是化合价的升降,即凡是有元素化合价升降的反应都是氧化还原反应。氧化钙和二氧化硅反应属于化合反应,化合价没有变化,是非氧化还原反应。答案选B。
本题难度:简单
2、选择题 下列反应中氯元素只被氧化的是
[? ]
A. 5Cl2+I2+6H2O=10HCl+2HIO3
B. MnO2+4HCl(浓) MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑
C. 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
D. BaCl2+Na2SO4=BaSO4↓+2NaCl
参考答案:B
本题解析:
本题难度:简单
3、填空题 (1)在试管里放入一小块铜片,注入一定体积的浓硫酸,给试管加热,使之反应。若铜片还有剩余硫酸是否消耗完毕?
①结论及理由是:_________________________________________。
②向100毫升18 mol/L的H2SO4溶液中加入足量的铜片并加热,充分反应后,被还原的H2SO4的物质的量?
A.小于0·9 mol B.等于0·9 mol C.在0·9 mol与1.8 mol之间? D.大于1·8 mol
③50g的胆矾加热到100℃失去部分结晶水后,质量变为35.6g,则失去水后的硫酸铜晶体的化学式是?
A.CuSO4·H2O B.CuSO4·2H2O? C.CuSO4·3H2O D.CuSO4
(2)足量的锌投入到一定量的浓硫酸中,充分反应后共收集到SO2和H222.4L(标准状况)。
①简述能产生H2的原因是____________?__________________
②上述变化中体现浓硫酸强氧化性的反应方程式是:?
③反应共消耗金属锌的质量为_________g。
④以上数据能否计算出消耗的硫酸的物质的量? _?(填“能”或“不能”)
参考答案:(12分)(1)①否,随反应进行,硫酸浓度不断降低,稀硫酸与铜不反应,所以硫酸会有剩余?②A?③A
(2)①随反应的不断进行,浓硫酸浓度不断降低,与锌稀硫酸反应产生了氢气
②Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O?③65?④不能
本题解析:(1)①由于随反应进行,硫酸浓度不断降低,稀硫酸与铜不反应,所以硫酸会有剩余。
②浓硫酸的物质的量是1.8mol,所以根据反应式Cu+2H2SO4(浓)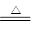 CuSO4+2H2O+SO2↑,并结合①可知,实际被还原硫酸的物质的量小于0.9mol,答案选A。
CuSO4+2H2O+SO2↑,并结合①可知,实际被还原硫酸的物质的量小于0.9mol,答案选A。
③50g的胆矾加热到100℃失去部分结晶水后,质量变为35.6g,则失去的水的质量是50g-35.6g=14.4g,物质的量是0.8mol。胆矾的物质的量是0.2mol,共计含有1mol水。这说明反应后含有的水的物质的量水0.2mol,所以化合物的化学式是CuSO4·H2O,答案选A。
(2)①由于随反应的不断进行,浓硫酸浓度不断降低,与锌稀硫酸反应产生了氢气。
②体现浓硫酸强氧化性的反应方程式是Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O。
③混合气的物质的量是1mol,由于不论是氢气,还是SO2,在反应中都是转移2个电子的,所以共计电子得失守恒可知,参加反应的锌的物质的量也是1mol,质量是65g。
④由于不能确定SO2的物质的量,所以无法确定消耗的硫酸的物质的量。
点评:该题是高考中的常见题型,试题综合性强,难易适中。该题在注重对基础性知识考查与训练的同时,主要是侧重培养学生的解题方法与技巧,有利于调动学生的学习兴趣,激发学生的求知欲。该题的关键是理解浓硫酸的化学性质,以及利用好守恒法在化学计算中的重要应用。
本题难度:一般
4、填空题 (8分)已知下列反应:(1)2Na + 2H2O ="==" 2NaOH + H2
(2)2F2+ H2O ="==" 4HF +O2?(3)Cl2 + H20 ="==" HCl + HClO
(4)C + H2O ="==" CO + H2
水只作氧化剂的是?,水只作还原剂的是?,水既不作氧化剂又不作还原剂的是?(填序号)
参考答案:(1)(4)?(2)?(3)
本题解析:考查氧化还原反应方程式的有关判断。得到电子的物质,即化合价降低的物质是氧化剂,所以答案选(1)、(4);失去电子的物质,即化合价升高的物质是还原剂,则答案选(2);在反应(3)中氯气既是氧化剂,又是还原剂,而水既不是氧化剂,也不是还原剂。
本题难度:一般
5、选择题 已知NH4CuSO3与足量的1mol·L-1硫酸溶液混合微热,产生下列现象:①有红色金属生成;②有刺激性气味气体产生;③溶液呈蓝色。据此判断下列说法合理的是(?)
A.NH4CuSO3中硫元素被氧化了
B.刺激性气味的气体是二氧化硫或氨气
C.该反应中NH4CuSO3既是氧化剂又是还原剂
D.该反应中硫酸既表现为酸性又表现氧化性
参考答案:C
本题解析:A项:溶液中的离子都不足以氧化亚硫酸根,S在反应前后都是+4价,故错。B项:氨气在酸性环境中更易生成铵根而保留在溶液中。D项:硫酸浓度不够,并不能体现出明显的氧化性。这里只是发挥酸化的作用。故选C。
点评:本题考查氧化还原反应,难度较大,注意从反应现象判断生成物,结合化合价的变化决定氧化剂和还原剂。
本题难度:简单