微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知H2B在溶液中的电离方程式:H2B = H++HB-, ?HB-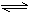 H++B2-。下列叙述一定正确的是
H++B2-。下列叙述一定正确的是
A. Na2B溶液存在:c (Na+) =" 2c" (HB-) + 2c(B2-) + 2c(H2B)?
B.NaHB溶液一定显酸性
C.HB-的水解方程式:HB-+H2O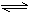 H2B+OH-
H2B+OH-
D.NaHB溶液与稀盐酸反应的离子方程式是:HB-+H+ = H2B
参考答案:B
本题解析:A 错误,题中给出,H2B = H++HB- ?溶液中不存在H2B?
B 正确,HB-只电离,不水解一定显酸性
C 错误,H2B 是强酸,所以HB-不水解
D 错误,H2B 是强酸,全部电离,不能写分子形式。
本题难度:一般
2、选择题 将0.1mol下列物质置于1L水中,充分搅拌后,溶液中阴离子数最多的是 ( )
A.KCl
B.Mg(OH)2
C.Na2CO3
D.MgSO4
参考答案:C
本题解析:因为Mg(OH)2难溶,故电离出的OH-很少,首先排除B选项;A、C、D三项中的物质溶于水后电离出相等数目的阴离子,但是A、D项中的Cl-、SO42-都是强酸的酸根,不发生水解,在溶液中不能产生其他离子,博得是等同的;C选项中的阴离子在溶液中部分水解;CO32-+H2O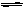 HCO3-+OH-,因而增加了溶液中的阴离子数目。
HCO3-+OH-,因而增加了溶液中的阴离子数目。
本题难度:一般
3、选择题 下列关于各溶液的描述中正确的是? ( )。
A.pH相等的①NH4Cl,②(NH4)2SO4,③NH4HSO4的溶液中,c(NH4+)大小:①=②=③
B.常温下,在10 mL pH=12的氢氧化钠溶液中加入pH=2的HA至pH刚好等于7,所得溶液体积V(总)≤20 mL
C.向1.00 L 0.3 mol·L-1的NaOH溶液中缓慢通入CO2气体至溶液增重8.8 g,所得溶液中:3c(Na+)=2[c(HCO3—)+c(CO32—)+c(H2CO3)]
D.浓度均为0.1 mol·L-1的CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-)-c(CH3COOH)=c(H+)-c(OH-)
参考答案:B
本题解析:NH4Cl,(NH4)2SO4溶液中NH4+水解使溶液呈酸性:NH4++H2O NH3·H2O+H+,但水解是微弱的,NH4HSO4=NH4++H++SO42—,H+全部电离,溶液呈酸性,故c(NH)相同的NH4Cl,(NH4)2SO4,NH4HSO4三溶液中,c(H+)大小:①=②<③,现三溶液pH相同,则c(NH4+)大小:①=②>③,A项错误;若HA为强酸,则等体积混合时,pH恰好等于7,V(总)=20 mL,若HA为弱酸,HA部分电离出H+,要使混合后溶液呈中性,则酸的体积必须小于10 mL,V(总)<20 mL,B项正确;0.3 mol NaOH与0.2 mol CO2反应:3NaOH+2CO2=Na2CO3+NaHCO3+H2O,所得溶液为等浓度的Na2CO3和NaHCO3混合液,溶液中n(Na)∶n(C)=3∶2,据此得物料守恒式:2c(Na+)=3[c(HCO3—)+c(CO32—)+c(H2CO3)],C项错误;等浓度的CH3COOH与CH3COONa的混合溶液中存在电荷守恒式:c(Na+)+c(H+)=c(OH-)+c(CH3COO-),故c(H+)-c(OH-)=c(CH3COO-)-c(Na+),D项错误。
NH3·H2O+H+,但水解是微弱的,NH4HSO4=NH4++H++SO42—,H+全部电离,溶液呈酸性,故c(NH)相同的NH4Cl,(NH4)2SO4,NH4HSO4三溶液中,c(H+)大小:①=②<③,现三溶液pH相同,则c(NH4+)大小:①=②>③,A项错误;若HA为强酸,则等体积混合时,pH恰好等于7,V(总)=20 mL,若HA为弱酸,HA部分电离出H+,要使混合后溶液呈中性,则酸的体积必须小于10 mL,V(总)<20 mL,B项正确;0.3 mol NaOH与0.2 mol CO2反应:3NaOH+2CO2=Na2CO3+NaHCO3+H2O,所得溶液为等浓度的Na2CO3和NaHCO3混合液,溶液中n(Na)∶n(C)=3∶2,据此得物料守恒式:2c(Na+)=3[c(HCO3—)+c(CO32—)+c(H2CO3)],C项错误;等浓度的CH3COOH与CH3COONa的混合溶液中存在电荷守恒式:c(Na+)+c(H+)=c(OH-)+c(CH3COO-),故c(H+)-c(OH-)=c(CH3COO-)-c(Na+),D项错误。
本题难度:一般
4、选择题 下列有关物质浓度关系的描述中,正确的是
A.25℃时,向0.1mol·L-1NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(NH4+)>c(SO42—)>c(OH—)=c(H+)
B.25℃时,NaB溶液的pH=8,c(Na+) + c(B-)=9.9×10-7mol·L-1
C.0.1mol·L-1的NaHCO3溶液中:c(OH-)+c(CO32-)=c(H+)+c(H2CO3)
D.同温下,pH相同时,溶液物质的量浓度:c(CH3COONa)<c(NaHCO3)<c(C6H5ONa)<c(Na2CO3)
参考答案:C
本题解析:A.25℃时,向0.1mol·L-1NH4HSO4溶液中滴加NaOH溶液至中性时违背溶液呈电中性原理。应该为c(Na+)>c(SO42—)>c(NH4+)>c(OH—)=c(H+)。错误。B. 在溶液中存在水解平衡:B-+H2O  ?HB+OH-。pH=8,c(H+)=10-8mol/Lc(OH-)=10-6mol/L根据溶液呈电中性原理c(Na+) + c(H+)=c(B-)+ c(OH-),c(Na+) -c(B-)=c(OH-)-c(H+)=9.9×10-7mol/L.错误。C.根据电荷守恒可得c(Na+) + c(H+)= c(OH-)+ 2c(CO32-)+ c(HCO3-);根据物料守恒可得c(Na+)= c(CO32-)+ c(HCO3-)+ c(H2CO3)。代入第一个式子可得c(OH-)+c(CO32-)=c(H+)+c(H2CO3)。正确。D对于同种浓度的强碱弱酸盐,酸越强,盐水解的程度就越小,盐溶液的pH就越小。若同温下,pH相同时,则生成盐的酸的酸性越强,该酸产生的盐的浓度就越大。酸性:CH3COOH> H2CO3>C6H5OH> HCO3-.所以同温下,pH相同时,溶液物质的量浓度c(CH3COONa) >c(NaHCO3) >c(C6H5ONa) >c(Na2CO3)。错误。
?HB+OH-。pH=8,c(H+)=10-8mol/Lc(OH-)=10-6mol/L根据溶液呈电中性原理c(Na+) + c(H+)=c(B-)+ c(OH-),c(Na+) -c(B-)=c(OH-)-c(H+)=9.9×10-7mol/L.错误。C.根据电荷守恒可得c(Na+) + c(H+)= c(OH-)+ 2c(CO32-)+ c(HCO3-);根据物料守恒可得c(Na+)= c(CO32-)+ c(HCO3-)+ c(H2CO3)。代入第一个式子可得c(OH-)+c(CO32-)=c(H+)+c(H2CO3)。正确。D对于同种浓度的强碱弱酸盐,酸越强,盐水解的程度就越小,盐溶液的pH就越小。若同温下,pH相同时,则生成盐的酸的酸性越强,该酸产生的盐的浓度就越大。酸性:CH3COOH> H2CO3>C6H5OH> HCO3-.所以同温下,pH相同时,溶液物质的量浓度c(CH3COONa) >c(NaHCO3) >c(C6H5ONa) >c(Na2CO3)。错误。
本题难度:一般
5、选择题 将0.1mol下列物质置于1L水中充分搅拌后,溶液中阳离子数最多的是(?)
A.KCl
B.Ag2S
C.AlCl3
D.CaCl2
参考答案:C
本题解析:此题涉及到物质溶解性、盐的水解等知识。依据“有弱才水解”规律,AlCl3能水解:Al3++3H2O Al(OH)3+3H+,由此可知,若有1mol Al3+水解,则能产生3mol H+,水解使阳离子数目增多。故C中阳离子数>0.1mol。A、D中nK+ =nCa2+=0.1mol(水电离出H+可忽略),B中的Ag2S在水中难溶,故溶液中阳离子数<0.1mol。
Al(OH)3+3H+,由此可知,若有1mol Al3+水解,则能产生3mol H+,水解使阳离子数目增多。故C中阳离子数>0.1mol。A、D中nK+ =nCa2+=0.1mol(水电离出H+可忽略),B中的Ag2S在水中难溶,故溶液中阳离子数<0.1mol。
错点警示:往往对盐的水解产生一种错误理解,即Al3+因水解而使Al3+浓度减小,本题已转移到溶液中阳离子总数多少的问题上。
本题难度:一般