| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点归纳《影响盐类水解的因素》高频试题巩固(2017年最新版)(六)
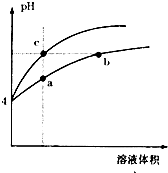 参考答案:盐酸溶液中的氢离子主要是盐酸电离出来的,盐酸完全电离,体积和pH都相同的盐酸和氯化铵溶液加水稀释的过程中,盐酸不能继续电离,盐酸溶液中氢离子浓度变化大;水解是微弱的,氯化铵溶液中铵离子可继续水解,溶液中的氢离子浓度变化小,所以含c点的曲线pH变化是盐酸溶液的,含a、b点的曲线pH变化是氯化铵溶液的. 本题解析: 本题难度:简单 3、选择题 常温下pH=3的二元弱酸H2R溶液与aL pH=11的NaOH溶液混合后,混合液的pH刚好等于7(假设反应前后体积不变),则对反应后混合液的叙述正确的是 参考答案:C 本题解析:略 本题难度:一般 4、选择题 已知常温下CH3COOH的电离平衡常数为Ka,常温下,向20mL 0.1 mol·L-1CH3COOH溶液中逐滴加入0.1 mol·L-1NaOH溶液,其pH变化曲线如图所示(忽视温度变化)。下列说法中错误的是 参考答案:C 本题解析: 本题难度:一般 5、选择题 对0.2mol·L-1碳酸钠溶液的微粒浓度分析正确的是? 参考答案:A、D 本题解析:碳酸钠为强减弱酸盐,其溶液发生如下电离和水解过程: 本题难度:一般 |
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点总结《氧化还原反.. | |