微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列说法不正确的是?
[? ]
A.通电一段时间后,搅拌均匀,溶液的pH增大
B.甲电极上的电极反应为:2Cl-?-2e-?=?Cl2↑
C.Pt电极上的电极反应为:O2+2H2O+4e-==4OH-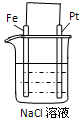 ?
?
D.总反应的离子方程式为: 2Fe3+ +Cu=Cu2+ +?2Fe2+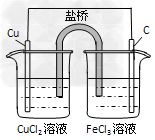
参考答案:A
本题解析:
本题难度:一般
2、填空题 碘缺乏症遍及全球,多发生于山区,南美的安第斯山区、欧洲的阿尔卑斯山区和亚洲的喜马拉雅山区是高发病地区。我国云南、河南等10余省的山区发病率也较高,据估计我国患者大约有1 000万人。为控制该病的发生,较为有效的方法是食用含碘食盐。我国政府以国家标准的方式规定在食盐 中添加碘酸钾(KIO3),据此回答下列问题。
(1)碘是合成下列哪种激素的主要原料之一(? )
A.胰岛素 B.甲状腺激素 C.生长激素 D.雄性激素
(2)长期生活在缺碘山区,又得不到碘盐的供应,易患(?)
A.甲状腺亢进 B.佝偻病 C.地方性甲状腺肿 D.糖尿病
(3)可用盐酸酸化的碘化钾和淀粉检验食盐中的碘酸钾。反应的化学方程式为___,氧化产物 与还原产物的物质的量之比为____,能观察到的明显现象是____。
(4)已知KIO3可用电解方法制得。原理是:以石墨为阳极,以不锈钢为阴极,在一定电流强度和温 度下电解KI溶液。总反应化学方程式为KI+ 3H2O KIO3+3H2↑,则两极反应式分别为阳极___,阴极____。
KIO3+3H2↑,则两极反应式分别为阳极___,阴极____。
(5)在某温度下,若以12 A的电流强度电解KI溶液10 min,理论上可得标准状况下氢气___L。
参考答案:(1) B
(2) C
(3) 5KI+ KIO3+6HCl=6KCl+ 3H2O+3I2 ;5:1 ;溶液变蓝色
(4)I-+3H2O -6e-=IO3-+6H+? ;6H+ +6e-=3H2↑
(5)0. 837
本题解析:
本题难度:一般
3、填空题 (1)埋在地下的输油铁管道,在下列情况下,①在含铁元素较多的酸性土壤中、②在潮湿疏松透气的土壤中、③在干燥致密不透气的土壤中、④在含碳颗粒较多,潮湿透气的中性土壤中。被腐蚀速率最慢的是___________________
(2)以石墨棒为两极,氯化铜溶液为电解液组成的电解池的阴极电极反应式是____________________在化学反应中发生的能量转变形式是__________________
参考答案:(1)③
(2)Cu2++2e-==Cu;电能转化为化学能
本题解析:
本题难度:一般
4、选择题 下列用来表示物质变化的化学用语中,正确的是
[? ]
A.电解饱和食盐水时,阳极的电极反应式为:2Cl- -2e-==Cl2 ↑
B.氢氧燃料电池的负极反应式:O2 + 2H2O + 4e- == 4OH-
C.粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu-2e- == Cu2+
D.钢铁发生电化学腐蚀的正极反应式:Fe-2e - == Fe2+
参考答案:A
本题解析:
本题难度:一般
5、填空题 防止和治理环境污染是当前环保工作的重要研究内容之一。
(1)氮肥厂的氨氮废水经过初步处理后可得到低浓度氨氮废水,后续处理流程如下:?
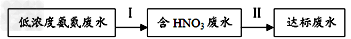
过程I:在硝化细菌作用下,O2将NH4+氧化为NO3-;
过程II:加入甲醇,NO3-和甲醇反应转化CO2和N2。
请写出过程I步的离子方程式:_________________?。
(2)Hg是水体污染的重金属元素之一。水溶液中二价汞的主要存在形态与Cl-、OH-的浓度关系如图所示[图中的物质或粒子只有Hg(OH)2为难溶物; pCl=-1gc(Cl-)]?
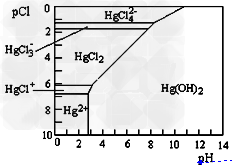
①下列说法中正确的是_____________。
A.为了防止Hg2+水解,配制Hg(NO3)2溶液时应将Hg(NO3)2固体溶于浓硝酸后再稀释。 B.当c(Cl-)?=10-1?mol·L-1时,汞元素一定全部以HgCl42-形式存在
C.HgCl2是一种弱电解质,其电离方程式是:HgCl2=HgCl+?+?Cl-
D.当溶液pH保持在4,pCl由2改变至6时,可使HgCl2转化为Hg(OH)2
②HgCl2又称“升汞”,熔点549K,加热能升华,其晶体是_________(填晶体类型)。
(3)汽车尾气是城市空气污染的一个重要因素,常用以下反应净化汽车尾气:
2NO(g)+2CO(g) ?2CO2(g)+N2(g) 在某温度T1℃下,2L密闭容器中充入NO?、CO各0.4mol,测得不同时间的NO和CO物质的量如下表:
?2CO2(g)+N2(g) 在某温度T1℃下,2L密闭容器中充入NO?、CO各0.4mol,测得不同时间的NO和CO物质的量如下表:

①根据上表的数据,在下图中画出CO2的物质的量与时间的关系曲线。
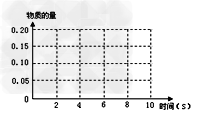
②上述反应达到平衡后,继续加入NO?、CO、CO2 各0.2mol和N2?__________?mol时,平衡不移动。
③在上述条件下该反应能够自发进行,如果把温度从T1℃升高到T2℃,平衡常数K将__________(填写“变大”、“变小”、“不变”)。
④一种CO分析仪的传感器可测定汽车尾气是否符合排放标准,该分析仪的工作原理类似燃料电池,其中的固体电解质是Y2O3-Na2O,O2ˉ可以在其中自由移动,负极的反应式为____________。
参考答案:(1)2O2+NH4+==NO3-+2H+?+H2O?
(2)①AD ;?②分子晶体
(3)①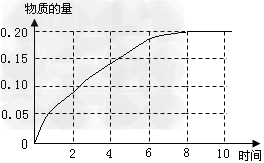 ?;
?;
②?0.1mol?;?③变小?;?④?CO+?O2--2e-=?CO2
本题解析:
本题难度:一般