|
高考化学知识点归纳《离子反应》试题强化练习(2017年最新版)(十)
2017-08-10 02:02:00
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (14分)氧化锌是橡胶、油漆、搪瓷、电缆、医药、电子、化学等工业的重要原料。以氧
化锌粗品为原料制备活性氧化锌的生产工艺流程如下:

(1).浸出”后得到的酸性溶液中含有Zn2+、SO42-,另含有Fe2+、Cu2+、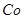 +、Mn2+等 +、Mn2+等
杂质。物质A的作用是调节溶液的pH至5 4,物质A最好选择________。
A.NH3.H2O
B.Na2CO3
C.H2SO4
D.ZnO
| 已知25℃时部分金属离子从开始形成氢氧化物沉淀到沉淀完全时溶液的pH如下表:
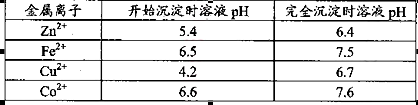
该温度下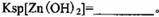 。 。
(2) KMnO4的作用是除去Mn2+和Fe2+,则KMnO4与Mn2+反应的离子方程式为_____________________________________;若溶液中 ,则处理1 ,则处理1 该溶液,Fe2+所消耗的KMnO4的质量为________g(保留两位有效数字)。 该溶液,Fe2+所消耗的KMnO4的质量为________g(保留两位有效数字)。
(3)杂质Cu2+、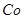 2+可利用置换反应除去,则物质B是_________。 2+可利用置换反应除去,则物质B是_________。
(4)被灼烧的沉淀是 ,生成该沉淀的化学方程式为________。 ,生成该沉淀的化学方程式为________。
如何检验该沉淀是否洗净?________________________________。
参考答案:(每空2分,共14分)
(1)? D? ; 1.0×10-20.2
(2)2MnO4―+3Mn2+ + 2H2O = MnO2+ 4H+?;? 26.33
(3)锌粉
(4)3Z nSO4 + 5NH3·H2O?+ NH4HCO3 = ZnCO3·2Zn(OH)2·H2O↓ + 3 (NH4)2SO4;
向最后一次的洗涤液中滴入1~2滴BaCl2溶液,若无明显的现象,则沉淀已洗净。
本题解析:(1)该流程的目的是制备氧化锌,所以为了不引入新的杂质,需要选择氧化锌 调节溶液的pH值,答案选D;Zn(OH)2完全沉淀时c(Zn2+)=1×10-5mol/L,c(OH-)=1×10-14/1×10-6.4=1×10-7.6mol/L,所以该温度下Zn(OH)2的Ksp= c(OH-)2×c(Zn2+)=1.0×10-20.2
(2)根据流程图可知,加入高锰酸钾后有二氧化锰沉淀出现,所以KMnO4与Mn2+反应生成二氧化锰,离子方程式为2MnO4―+3Mn2+ + 2H2O = MnO2+ 4H+?;根据得失电子守恒规律,存在MnO4-~3Fe2+,1m3的该溶液中n(Fe2+)=0.5mol,则需要KMnO4的质量为0.5mol/3×158g/mol=26.33g;
(3)杂质Cu2+、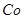 2+可利用置换反应除去,同样是为了不能引入新的杂质,B应是锌粉; 2+可利用置换反应除去,同样是为了不能引入新的杂质,B应是锌粉;
(4)生成ZnCO3·2Zn(OH)2·H2O应是在加入碳酸氢铵与氨水后产生的,溶液中的硫酸锌与之反应生成的沉淀,所以化学方程式为3ZnSO4 + 5NH3·H2O?+ NH4HCO3 = ZnCO3·2Zn(OH)2·H2O↓ + 3 (NH4)2SO4; 该沉淀中还可能含有硫酸根离子,所以检验洗涤是否干净的方法就是检验硫酸根离子是否存在,具体操作为向最后一次的洗涤液中滴入1~2滴BaCl2溶液,若无明显的现象,则沉淀已洗净。
本题难度:一般
2、选择题 下列物质的水溶液能导电,但其本身属于非电解质的是
A.液氯
B.蔗糖
C.SO3
D.KNO3
参考答案:C
本题解析:液氯属于单质,既不是电解质也不是非电解质,蔗糖虽属于非电解质,但水溶液不能导电。SO3属于非电解质,溶于水发生反应SO3+H2O=H2SO4,可以电离出自由移动的离子,故可以导电。
本题难度:简单
3、填空题 水是生命之源,水处理工艺在生产生活中占有重要地位。自来水生产的流程示意图如下。(净水剂亦称混凝剂,常用的净水剂有聚合氯化铝、碱式氯化铝、硫酸亚铁、聚丙烯酰胺、聚合氯化铝铁、三氯化铁、聚合硫酸铁等)
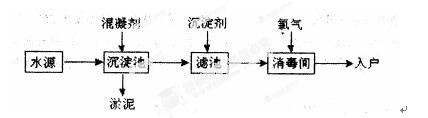
(1)FeSO4·7H2O是常用的混凝剂,它在水中最终生成?沉淀。
(2)[A12(OH)nClm]是一种无机高分子的高价聚合电解质混凝剂,可视为介于三氯化铝和氢氧化铝之间的一种中间水解产物,则m与n之间的关系??;
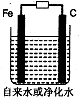
(3)推销净水器的商人用自来水做电解实验,装置如图。一段时间后,两极间产生白色沉淀,并很快变成红褐色,然后用净水器净化后的水做电解实验;两极上只有气体产生,水中并无沉淀,以此来说明自来水很“脏”。则沉淀变成红褐色时所发生的化学反应方程式为:?。
(4)MnSO4是水质检测中的一种常用试剂
①MnSO4和过硫酸钾(K2S2O8)两种盐溶液在银离子催化下可发生氧化还原反应,生成高锰酸钾、硫酸盐及另外一种产物,写出并配平上述反应的化学方程式:?。?
②水中的溶解氧测定过程为:取水样,迅速加入MnSO4和KOH混合液,再加入KI溶液,立即塞好塞子,振荡使完全反应(反应为:Mn2++O2+H2O→MnOOH,未配平)。打开塞子,迅速加入适量硫酸溶液,此时有碘单质生成。则该离子反应方程式:?。用Na2S2O3溶液滴定生成的碘,根据消耗溶液的体积可计算出水中溶解氧的量。
参考答案:
(1)Fe(OH)3?
(2)m+n=6
(3)4Fe(OH)2+O2+2H2O=4Fe(OH)3
(4)①2MnSO4+5K2S2O8+8H2O=2KMnO4+4K2SO4+8H2SO4,(Ag+催化剂)
②6H++2MnOOH+2I-=I2+2Mn2++4H2O
本题解析:
(1)FeSO4·7H2O溶于水,水解之后生成Fe(OH)2,继续被氧化成Fe(OH)3胶体,Fe(OH)3胶体有很强的吸附能力,将水中的悬浮颗粒物吸附并沉降下来,所以最终生成Fe(OH)3沉淀。
(2)由[A12(OH)nClm],根据化合价整体为0,因此m+n=6。
(3)铁在阳极放电,电极反应为:Fe-2e-=Fe2+,之后Fe2+ + 2OH- =Fe(OH)2↓,Fe(OH)2易被氧化,4Fe(OH)2?+O2+2H2O=4Fe(OH)3↓白色沉淀变成红褐色。
(4)①陌生情景下氧化还原反应方程式的书写步骤是:先写骨架(氧化剂、还原剂、氧化产物、还原产物),再根据电子守恒把骨架配平,最后根据原子守恒在方程式的两边在“H2O”上做文章。根据题意,硫酸锰被氧化成高锰酸钾,则过硫酸钾被还原成硫酸盐(硫酸钾),所以骨架为硫酸锰、过硫酸钾、高锰酸钾、硫酸钾,根据电子守恒把骨架配平,再根据原子守恒,方程式的左边有12个硫原子,右边只有4个硫原子,所以右边还缺8个硫原子,同时化合价应该是+6价,而钾原子已经守恒,所以只能是硫酸,如果在右边添加8H2SO4 ,再根据氢原子或者氧原子守恒,在方程式的左边补充“8H2O”。 ②取水样,迅速加入MnSO4和KOH混合液,再加入KI溶液,发生题干中的反应,即Mn2+被氧化成MnOOH,加入硫酸后,I-在酸性条件下被MnOOH氧化成I2,这也是一个氧化还原反应,书写思路同上,先写骨架并配平,再根据电荷守恒和原子守恒,在左边补充H+,在右边补充“H2O”即可。
本题难度:一般
4、选择题 在溶液中能大量共存且溶液无色的一组离子是
A.Mg2+ ?SO42- ?OH- ?K+
B.Cu2+ ?NO3- ? Cl- ?H+
C.H+ ? Na+ ? Cl- SO42-
D.K+ ? H+ ? Cl- OH-
参考答案:C
本题解析:试题分析:A Mg2+ 和OH-不共存; B Cu2+ 有颜色蓝色; D H+和OH-不共存。故选C。
考点:离子共存
点评:审题时应注意题中给出的附加条件。
①酸性溶液(H+)、碱性溶液(OH-)、能在加入铝粉后放出可燃气体的溶液、由水电离出的H+或OH-=1×10-10mol/L的溶液等。
②有色离子MnO4-,Fe3+,Fe2+,Cu2+,Fe(SCN)2+。
③MnO4-,NO3-等在酸性条件下具有强氧化性。
④S2O32-在酸性条件下发生氧化还原反应:S2O32-+2H+=S↓+SO2↑+H2O
⑤注意题目要求“大量共存”还是“不能大量共存”。
本题难度:一般
5、填空题 按要求填空
(一)、X、Y和Z均为短周期元素,原子序数依次增大,X的单质为密度最小的气体,Y的一种单质具有特殊臭味,Z与X原子最处层电子数相同。回答下列问题:
(1)由上述元素组成的化合物中,既含有极性共价键又含有离子键的化合物的电子式?;
(2)X和Y组成的化合物中,有一种既含有极性共价键又含有非极性共价键。此化合物可将碱性工业废水中的CNˉ氧化为碳酸盐和氨,相应的离子方程式为?
(二)、在一定条件下,RO3nˉ和Iˉ发生反应,离子方程式为: RO3nˉ+6Iˉ+6H+==Rˉ+3I2+3H2O?
RO3nˉ-中R元素的化合价为?,R元素的原子最外层电子有?个。
(三)、Na2Sx在碱性溶液中可被NaClO氧化为Na2SO4,而NaClO被还原为NaCl,若反应中Na2Sx与NaClO的物质的量之比为1︰16,则x值是?
(四)、已知M2On2ˉ可与R2ˉ作用,R2ˉ被氧化为R的单质,M2On2ˉ的还原产物中,M为+3价,又知c(M2On2ˉ)=0.3mol/L的溶液100mL可与c(R2ˉ)=0.6mol/L的溶液150mL恰好完全反应,则n值为?。
参考答案:(一)(1)NaOH?(2)H2O2+CN-+OH-=CO32-+NH3
(二)+5? 7 ?(三)5?(四)7
本题解析:
(一)(1)NaOH满足条件?(2)略
(二)根据离子反应电核守恒思想,可以推断反应前的离子所带电核总数为-1(因为反应后离子所带电核总数为-1)。又因为I-与H+离子所带电核总数为之和为0,因此RO3 n-所带电核数为-1,因此n=1。于是可以推断RO3 n-中R的化合价为+5;(2)由于R-只带一个单位负电核,说明R原子只能得到一个电子。因此R最外层电子数为7
(三)得失电子守恒,化合价升降相等
1Na2Sx?中S的化合价-2/x价
1Na2Sx---------------Na2SO4?化合价升高x×(6+2/x),
16NaClO-------------NaCl?化合价降低16×2=32
升降相等 x×(6+2/x)=32? x=5
(四)100ml 0.3 mol·L-1M2On2-中M为n-1价?被还原为2M 3+
0.6mol·L-1150mLR2-被氧化为R单质根据得失电子守恒: 0.1*0.3*2(n-1-3)=0.15*0.6*[0-(-2)]
解得:n=7
本题难度:一般
| 
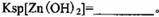 。
。 ,则处理1
,则处理1 该溶液,Fe2+所消耗的KMnO4的质量为________g(保留两位有效数字)。
该溶液,Fe2+所消耗的KMnO4的质量为________g(保留两位有效数字)。 2+可利用置换反应除去,则物质B是_________。
2+可利用置换反应除去,则物质B是_________。 ,生成该沉淀的化学方程式为________。
,生成该沉淀的化学方程式为________。