微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列各组溶液之间的反应,所用离子方程式表示相同的是( )
A.硝酸钡与稀硫酸,氯化钡与硫酸钠
B.盐酸与碳酸钠,盐酸与碳酸氢钠
C.氢氧化钠与硫酸,氢氧化钡与硫酸
D.氢氧化钠与盐酸,氢氧化钾与醋酸
参考答案:A
本题解析:A选项均可用Ba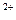 +SO
+SO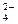
 BaSO
BaSO ↓表示;B选项中CO
↓表示;B选项中CO 和HCO
和HCO 书写形式不同;C选项中氢氧化钡和硫酸反应,Ba
书写形式不同;C选项中氢氧化钡和硫酸反应,Ba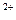 和SO
和SO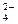 也参与了反应;D选项中醋酸是弱酸,应以化学式表示。
也参与了反应;D选项中醋酸是弱酸,应以化学式表示。
本题难度:一般
2、选择题 某溶液中仅含有Na+、Mg2+、SO42-、Cl-四种离子,其物质的量浓度比为Na+:Mg2+:Cl-=3:5:5,若Na+浓度为3mol/L,则SO42-的浓度为
A.2mol/L
B.3mol/L
C.4mol/L
D.8mol/L
参考答案:C
本题解析:
本题难度:一般
3、填空题 (6分)一瓶澄清的溶液,其中可能含有NH4+、K+、Mg2+、Ba2+、Al3+、Fe3+、SO42-、CO32-、NO3-、I-,取该溶液进行以下实验:
a.用pH试纸测得该溶液呈酸性;
b.取部分溶液,加入数滴新制的氯水及少量CCl4,经振荡、静置后,CCl4层呈紫红色;
c.另取部分溶液,逐滴加入稀NaOH溶液,使溶液从酸性逐渐变为碱性,在整个滴加过程中无沉淀生成;
d.取部分上述碱性溶液,加入Na2CO3溶液,有白色沉淀生成,
e.将③得到的碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝。
根据上述实验事实确定:
①写出b所发生反应的离子方程式?;
②该溶液中肯定存在的离子是?;
③该溶液中肯定不存在的离子是?。
参考答案:(6分)2I-+Cl2=2Cl-+I2 ;H+、NH4+、Ba2+、I-?;Mg2+、Al3+、Fe3+、SO42-、CO32-、NO3-
本题解析:用pH试纸测得该溶液呈酸性,所以一定存在氢离子,不存在CO32-;CCl4层呈紫红色,说明有单质碘生成,因此一定含有I-。由于在酸性条件下,NO3-能氧化I-,所以原溶液中一定不存在NO3-;逐滴加入稀NaOH溶液,使溶液从酸性逐渐变为碱性,在整个滴加过程中无沉淀生成,说明不存在Mg2+、Al3+、Fe3+;取部分上述碱性溶液,加入Na2CO3溶液,有白色沉淀生成,则白色沉淀一定是碳酸钡,所以一定含有Ba2+,则就一定不存在SO42-;将③得到的碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝,说明气体是氨气,所以一定含有NH4+。
点评:进行物质的检验时,要依据物质的特殊性质和特征反应,选择适当的试剂和方法,准确观察反应中的明显现象,如颜色的变化、沉淀的生成和溶解、气体的产生和气味、火焰的颜色等,进行判断、推理、验证即可。
本题难度:一般
4、填空题 某无色溶液,其中有可能存在的离子如下:Na+、Ag+、Ba2+、Al3+、AlO2-、S2-、CO32-、SO32- 、SO42-。现取该溶液进行有关实验,实验结果如下图所示:
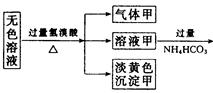
(1)沉淀甲是??,生成沉淀的离子方程式??。
(2)沉淀乙是??,由溶液甲生成沉淀乙的离子方程式??。
(3)沉淀丙是??。
(4)综合上述信息,可以肯定存在的离子有??。
参考答案:(1)S;? 2S2-+SO32-+6H+=3S↓+3H2O
(2)Al(OH)3; Al3++3HCO =Al(OH)3↓+3CO2↑
=Al(OH)3↓+3CO2↑
(3)BaCO3, 可能有BaSO4;?在沉淀丙中加入足量盐酸,若沉淀不能全部溶解,说明除BaCO3外还有BaSO4;若全部溶解,则仅有BaCO3.
(4) S2-、SO 、AlO
、AlO 、Na+
、Na+
本题解析:本题的突破口是沉淀甲、乙、丙的成分,加入过量的氢溴酸生成淡黄色沉淀甲,回顾中学化学中常见的淡黄色物质有AgBr、S、Ag3PO4等。这里应该排除排除Ag3PO4的,关键甲是AgBr还是S?若是AgBr沉淀的话,由于Ag+与题干中的4种阴离子均不能大量共存,从而否决了Ag+。可知甲是S,显然此处的S是溶液中S2-和SO32-在酸性条件下发生的归中反应生成的。由此推出原溶液中存在S2-和SO32-。由于有SO32-,所以一定不存在Ba2+、Fe3+。根据电中性原则,溶液中必须有阳离子,故一定存在Na+。气体甲可能是HBr与过量的S2-反应生成的H2S,也可能是HBr与过量的SO32-反应生成的SO2,也可能是HBr与原溶液中可能存在的CO32-反应生成的CO2。过量的NH4HCO3中和多余的H+后,又反应生成白色沉淀乙,对照题干中的离子(Ag+、Ba2+、Fe3+都不存在),推出沉淀乙只可能是Al元素引起的Al(OH)3沉淀,即HCO3-与Al3+发生双水解所造成的,而Al3+来自于AlO2-与过量的氢溴酸反应生成的,所以原溶液中一定存在AlO2-。气体乙是HCO3-与剩余的H+以及Al3+反应产生的,只能是CO2。Ba(OH)2与上步过量的NH4HCO3反应,生成白色沉淀丙,即BaCO3沉淀,另外,也可能存在BaSO4沉淀,但无法确定原溶液中是否含有CO32-和SO42-。气体丙一定是NH4+与过量的Ba(OH)2反应生成的NH3。
综上所述,肯定存在的离子有:Na+、AlO2-、S2-、SO32-;一定不存在的离子有:Ag+、Ba2+、Fe3+;可能存在的离子有:CO32-、SO42-。
本题难度:一般
5、选择题 某溶液中含有NH4+、SO32-、SiO32-、Br-、CO32-、Na+,向该溶液中通入过量的Cl2,下列判断正确的是:
①反应前后,溶液中离子浓度基本保持不变的有NH4+、Na+ ②有胶状物质生成
③有气体产生 ④溶液颜色发生变化 ⑤共发生了2个氧化还原反应
A.①②③④
B.②③④
C.①③⑤
D.②④⑤
参考答案:A
本题解析:Cl2+H2O=H+Cl-+HClO? 2H++SiO32-=H2SiO3↓?
2H++CO32-=H2O+CO2↑? Cl2+2Br-=2Cl-+Br2
Cl2+SO32-+H2O=2H++SO42-+2Cl-
由以上反应方程式可知:有硅酸胶状沉淀产生、有二氧化碳气体生成、因为有溴的生成而使溶液由无色转化为黄色;其中有三个氧化还原反应、NH4+、Na+没有参加反应,浓度基本不变。故答案为A
本题难度:一般