微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 用大试管收集一试管NO2气体,倒扣在盛水的水槽里,试管内产生的现象为?;再往试管里通入适量氧气,试管内又产生的现象为?。产生上述现象的原因是?
参考答案:试管内红棕色气体逐渐消失,水面上升至试管容积的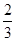 处 试管内又出现红棕色,接着红棕色消失,液面又上升。
处 试管内又出现红棕色,接着红棕色消失,液面又上升。
本题解析:用大试管收集一试管NO2气体,倒扣在盛水的水槽里,NO2与H2O反应:3NO2+H2O=2HNO3+NO,故颜色消失,液面上升至容积的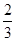 处;再充入O2时,发生反应2NO+O2=2NO2,故又出现了红棕色,NO2继续溶于水并与水反应,气体颜色又消失,液面又上升。2、NO的性质及反应现象的描述。
处;再充入O2时,发生反应2NO+O2=2NO2,故又出现了红棕色,NO2继续溶于水并与水反应,气体颜色又消失,液面又上升。2、NO的性质及反应现象的描述。
本题难度:一般
2、实验题 某课外活动小组在实验室用下图的一些装置组合后,快速制取氨并验证氨的某些性质,同时收集少量纯净氮气,请回答:

(1)写出用熟石灰和氯化铵反应制氨气的化学方程式??
(2) 本实验进行一断时间后,观察到加热的硬质玻璃试管内黑色氧化铜粉末转为红色,盛无水硫酸铜的干燥管内出现蓝色,并且在最后的出气导管处收集到纯净、干燥的氮气。根据这些现象,写出在硬质玻璃试管内发生反应的化学方程式:?,这个反应说明氨气具有____(填编号:A、碱性;B、还原性;C、氧化性; D、不稳定性)
(3) 洗气瓶中盛浓硫酸的主要作用是__________________
(4) 在最后的出气的导管口收集干燥、纯净的氮气,收集方法是:___________
(填编号:A、排气法? B、排水法? C、用气囊收集)
(5)装置E的作用是_______________。装置F验证的气体是___________。
参考答案:(1)2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O
CaCl2+2NH3↑+2H2O
(2)2 NH3+3CuO N2+3Cu+3H2O? B
N2+3Cu+3H2O? B
(3) 干燥N2?除去少量NH3?(4)C?(5)干燥NH3?H2O
本题解析:(2)浓氨水滴入生石灰中,生石灰溶于水放热,使氨水分解同时生石灰与水反应生成氢氧化钙,氢氧根离子浓度增大,使NH3+H2O NH3·H2O
NH3·H2O NH4++OH-电离平衡向左移动,氨气逸出,所以用浓氨水和生石灰可以快速制氨气。碱石灰的作用是干燥氨气,E中发生氨气还原氧化铜的反应,黑色粉末变红说明生成了铜,无水硫酸铜变蓝说明生成了水,同时还有氮气生成,由此可写出反应方程式2 NH3+3CuO
NH4++OH-电离平衡向左移动,氨气逸出,所以用浓氨水和生石灰可以快速制氨气。碱石灰的作用是干燥氨气,E中发生氨气还原氧化铜的反应,黑色粉末变红说明生成了铜,无水硫酸铜变蓝说明生成了水,同时还有氮气生成,由此可写出反应方程式2 NH3+3CuO N2+3Cu+3H2O,反应中-3价的氮全部升为0价,氨气表现还原性。
N2+3Cu+3H2O,反应中-3价的氮全部升为0价,氨气表现还原性。
(3)洗气瓶中浓硫酸的作用是干燥N2、吸收多余的氨气,防止氨气逸出污染环境。
(4)收集纯净、干燥的氨气用气囊收集。
(5)E的作用是干燥氨气,F验证的气体是水蒸气。
点评:掌握实验室快速制氨气的方法:向生石灰或固体氢氧化钠或碱石灰中滴加浓氨水。
本题难度:一般
3、计算题 (8分)Cu与一定浓度的硝酸反应时,其方程式可表示为:
Cu+HNO3 ——Cu(NO3)2+NO↑+NO2↑+H2O
(1)硝酸在反应中的性质是?。
(2) 0.3molCu被完全溶解后,如果得到的NO和NO2物质的量相同,则参加反应的硝酸的物质的量是?mol,若用排水法收集这些气体,可得到标准状况下的体积??L。
(3)如果参加反应的Cu和HNO3的物质的量之比为3:10,写出并配平该反应的离子方程式?
参考答案:(1)氧化性、酸性?(2)0.9?; 4.48
(3)3Cu +10H+ +4NO3-==3Cu2+ +NO↑+3NO2↑+5H2O
本题解析:(1)在生成物中有硝酸铜产生,所以体现出硝酸的酸性。又因为硝酸中氮元素的化合价降低,所以还体现了硝酸的氧化性。
(2)根据得失电子守恒可知0.3mol×2=n(NO)×3+n(NO2)×1。因为NO和NO2的体积相等,所以它们的物质的量都是0.15mol,则被还原的硝酸是0.3mol。硝酸铜是0.3mol,所以没有被还原的硝酸是0.6mol,则参加反应的硝酸就是0.3mol+0.6mol0.9mol。NO2溶于水的方程式为3NO2+H2O=2HNO3+NO,所以最后收集到到NO是0.15mol+0.15mol/3=0.2mol,在标准状况下到体积是0.2mol×22.4L/mol=4.48L。
本题难度:一般
4、选择题 通常情况下气体能共存的是
A.N2、O2
B.NH3、HCl
C.NO、O2
D.H2S、SO2
参考答案:A
本题解析:物质能否共存,主要是看这两种物质混合时能否发生反应.A项中的N2和O2在常温下不反应,只有在电火花作用下才能反应生成NO;B项生成NH4Cl;C项生成NO2;D项是S元素的归中反应,生成单质硫.
本题难度:简单
5、选择题 将51.2gCu完全溶于适量浓硝酸中,收集到氮的氧化物(含NO、NO2、N2O4)的混合物共0.8mol,这些气体恰好能被500mL2mol/L NaOH溶液完全吸收,溶液中生成NaNO3和NaNO2,则原混合气体中NO的物质的量为
A.0.3 mol
B.0.4 mol
C.0.5 mol
D.0.6 mol
参考答案:A
本题解析:51.2gCu的物质的量为0.8mol,根据氧化还原反应过程中得失电子数相等可得, 0.8molCu失去1.6mol电子,相当于生成了NaNO2时N原子得到了1.6mol电子,即有NaNO20.8mol;根据钠守恒得生成了NaNO3 0.2mol;根据方程式
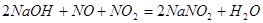
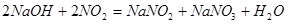 联立可求,原混合气体中NO的物质的量为0.3 mol
联立可求,原混合气体中NO的物质的量为0.3 mol
本题难度:一般