微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (4分)维生素和微量元素是生命基础的重要物质。如中学生每天需要补充维生素C约60 mg,微量元素碘约150 μg。
 (1)维生素C又称抗坏血酸,其水溶液显酸性。向维生素C的溶液中滴加紫色石蕊溶液,溶液变?色。
(1)维生素C又称抗坏血酸,其水溶液显酸性。向维生素C的溶液中滴加紫色石蕊溶液,溶液变?色。 某同学欲探究维生素C的还原性,可选择的试剂是?(填序号)。
某同学欲探究维生素C的还原性,可选择的试剂是?(填序号)。
 ①氨水、淀粉?
①氨水、淀粉? ?② KI溶液?③酸性KMnO4溶液
?② KI溶液?③酸性KMnO4溶液
 (2)加碘盐可预防碘缺乏症,其中加入的含碘物质是碘酸钾。碘酸钾的化学式为?(填序号)。
(2)加碘盐可预防碘缺乏症,其中加入的含碘物质是碘酸钾。碘酸钾的化学式为?(填序号)。
 ① I2?
① I2? ?② KI?③ KIO3
?② KI?③ KIO3
 已知在酸性条件下,碘化钾与碘酸钾反应可生成碘单质。若用盐酸酸化的碘化钾淀粉溶液检验加碘盐中的碘酸钾,可观察到的现象是?。
已知在酸性条件下,碘化钾与碘酸钾反应可生成碘单质。若用盐酸酸化的碘化钾淀粉溶液检验加碘盐中的碘酸钾,可观察到的现象是?。
参考答案:红?③;③;?溶液变蓝
本题解析:略
本题难度:一般
2、选择题 下列反应中,属于氮的固定的是(?)
A.空气在雷电的作用下产生NO
B.NH3经催化氧化生成NO
C.NO2和H2O反应生成HNO3
D.由NH3制碳酸铵或硫酸铵
参考答案:A
本题解析:将空气中游离态的氮转化为含氮化合物的过程叫氮的固定。因此,B、C、D都是错误的。故选A。
点评:本题考查的是氮的固定。氮的固定是指将空气中游离态的氮转化为含氮化合物的过程,只要学生学习过程中牢记并理解这些基本定义,便不难解答此题。
本题难度:简单
3、选择题 下图为两个连通容器,中间用活塞分开,左、右两室各充入一定量NO和O2,且恰好使两容器内气体密度相同。打开活塞,使NO与O2充分反应,最终容器内混合气体密度与原来相比(?)
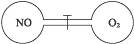
A.增大
B.减小
C.不变
D.无法确定
参考答案:C
本题解析:由图可知该容器为密闭容器,所以反应前后混合气体质量不变,反应前两容器内气体密度相同,打开活塞后,NO和O2充分反应,但体积未变,所以密度不变。选C。
本题难度:简单
4、选择题 下列食品添加剂与类别对应不正确的是(?)
A.调味剂——亚硝酸钠
B.防腐剂——苯甲酸钠
C.疏松剂——碳酸氢钠
D.着色剂——叶绿素
参考答案:A
本题解析:A、亚硝酸钠具有毒性,不能用作调味品,故A应用错误;
B、苯甲酸钠具有防腐性,可以用作防腐剂,故B应用正确;
C、碳酸氢钠受热能分解生成二氧化碳,可以使食品变得疏松,能用作疏松剂,故C应用正确;
D、叶绿素显示绿色,能用于着色剂,故D应用正确;
故选A.
本题难度:简单
5、填空题 (14分)氨气是一种重要的物质,可用于制取化肥和硝酸等。
(1)氨气催化氧化的化学方程式为?。
 ?(2)工业合成氨的热化学方程式为:N2(g)+3H2(g)? 2NH3(g);△H=-92.2kJ/mol。
?(2)工业合成氨的热化学方程式为:N2(g)+3H2(g)? 2NH3(g);△H=-92.2kJ/mol。
有关键能:N="N945.6kJ/mol" N-H391.0kJ/mol,则H—H键能为?。
(3)500°C、50Mpa时,在容积为VL的定容器中加入n mol N2、3n mol H2,反应达到平衡后N2的转化率为a。则容器内气体的压强反应前与平衡时的比值为?。
(4)合成氨原料中的H2可用甲烷在高温下与水蒸气反应制得。部分1mol物质完全燃烧生成常温下稳定氧化物的△H数据如下表:
物质
| △H(kJ/mol)
|
H2(g)
| -285.8
|
CO(g)
| -283.0
|
CH4(g)
| -890.3
|
?已知1 mol H2O(g)转变为1molH2O(l)时放热44.0kJ。写出CH4和水蒸气在高温下反应得到CO和H2的热化学方程式?。
(5)有人设想寻求合适的催化剂和电极材料,以N2、H2为电极反应物,以HCl—NH4Cl为电解质溶液制取新型燃料电池。写出该电池的正极反应式?。
(6)若把标准状况下6.72L氨气通入到100g19.6%的硫酸溶液中,所得溶液中的溶质是
?,溶液中离子浓度从大到小的顺序是?。
参考答案:
(1)
(2)436.1kJ/mol
(3)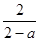
(4)CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.1kJ/mol
(5)N2+8H++6e-=2NH+4
(6)硫酸铵和硫酸氢铵;c(NH+4)>c(SO2-4)>c(H+)>c(OH-)
本题解析:(1)氨气催化氧化的化学方程式为:4NH3+5O2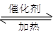 4NO+6H2O
4NO+6H2O
(2)945.6+3(H-H)-6×391.0=-92.2? H-H的键能=436.1kJ/mol
(3)N2+ 3H2 2NH3
2NH3
起始? n? 3n? 0
转化 na? 3na? 2na
平衡n(1-a) 3n(1-a)? 2na
起始的物质的量为4n,平衡时的物质的量为n(1-a)+ 3n(1-a)+2na=4n-2na
则容器内气体的压强反应前与平衡时的比值为2/(2-a)
(4)CH4和水蒸气在高温下反应得到CO和H2的热化学方程式:
CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.1kJ/mol
(5)正极反应是:N2+8H++6e-=2NH4+
(6)所得溶液中的溶质是硫酸铵和硫酸氢铵,溶液中离子浓度从大到小的顺序是:c(NH+4)>c(SO2-4)>c(H+)>c(OH-)
本题难度:一般