| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点整理《化学平衡状态的判断》试题预测(2017年最新版)(四)
a.请在上表空格中填入剩余的实验条件数据。 b.根据反应II的特点,在给出的坐标图中,画出在5MPa条件下CO的转化率随温度变化的趋势曲线示意图,并标明压强。 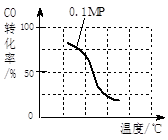 参考答案:(1)①0.003mol/(L·min)(2分)?②<(2分)2.25×10-4(3分) ? 本题解析:⑴①0.003mol/(L·min)?②<2.25×10-4?⑵③反应Ⅱ为熵减的反应,要自发反应必须为放热反应,故△H?<?0,若容器容积不变,可增加甲醇产率的措施有BD。④a通过“控制变量法”探究外界条件对化学平衡的影响,探究的前提只能是改变一个条件,而其它条件不变,由此可得:Ⅱ中温度为150℃,n?(CO)/n(H2)=1/3,Ⅲ中n?(CO)/n(H2)为1/3; 本题难度:困难 4、选择题 在-50℃时,液氨的电离跟水的电离相似,存在平衡,2NH3(l) 参考答案:A 本题解析:仔细观察液氨的电离方程式,不难发现液氨的电离类似于水的电离,均属于“质子(H+)转移自电离”, 其中NH4+和NH2-分别相当于纯水中水电离出的H3O+和OH-。由此类比推出,液氨的性质应类似于水,如液氨可以与金属钠反应生成H2和NaNH2;影响液氨电离平衡的因素也类似于水。液氨的离子积(也应该只是温度的函数)为常数,此温度下会恒等于1×10-30。故选项A不正确,BCD正确,答案选A。 本题难度:简单 5、选择题 在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表: 参考答案:C 本题解析:题中有一明显的错误,就是C选项中平衡常数增大,增大压强不可能使平衡常数增大。其他选项均为平衡中的基础计算和基础知识,关键是根据表中数据(0.1-0.05)∶(0.2-0.05) ∶(0.1-0)=1∶3∶2可推导出:X+3Y 本题难度:一般 |
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点总结《物质的量》.. | |