微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 Ⅰ.盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列的5个反应(由氨气、HCl和水制备NH4C1水溶液)。请判断反应④的反应热:ΔH= 。
① NH3(g) + HCl(g) = NH4Cl(s) ΔH=-176kJ·mol
参考答案:
本题解析:
本题难度:一般
2、选择题 下列叙述正确的是(?)
A.越难失电子的元素得电子能力一定越强
B.溶于水可以导电的化合物一定是离子化合物
C.第三周期元素的最高正化合价等于它所处的主族序数
D.离子化合物中可以含有共价键,共价化合物可以含有离子键
参考答案:C
本题解析:越难失电子的元素得电子能力不一定越强,例如稀有气体元素,A不正确;溶于水可以导电的化合物不一定是离子化合物,例如氯化氢是共价化合物,B不正确;离子化合物中可以含有共价键,共价化合物不可能含义离子键,答案选C。
点评:该题是中等难度的试题,试题基础性强,在注重对学生基础知识巩固和检验的同时,侧重对学生能力的培养。该题的关键是学会通过举例逐一排除筛选得出正确结论的方法,有利于调动学生的学习兴趣,提高学生的应试能力。
本题难度:一般
3、选择题 下图是吸热反应的是( )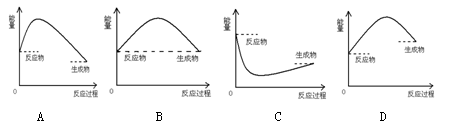
参考答案:D
本题解析:反应物的总能量低于生成物的总能量,则需要自外界吸收能量,为吸热反应。
本题难度:一般
4、填空题 (12分)工业上用CO生产燃料甲醇.一定条件下发生反应:CO(g)+2H2(g) ?CH3OH(g)
(1)下图表示该反应进行过程中能量的变化,曲线a表示不使用催化剂时反应的能量变化,曲线b表示使用催化剂后的能量变化。该反应是 (填“吸热”或“放热”)反应,写出反应的热化学方程式 ;

选择适宜的催化剂, (填“能”或“不能”)改变该反应的反应热。
(2)该反应平衡常数K的表达式为K= ,温度升高,平衡常数K (填“增大”、“不变”或“减小”);
(3)恒容条件下,下列措施中能使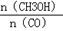 增大的有 。
增大的有 。
a.升高温度 b.充入He气 c.再充入1molCO和2molH2 d.使用催化剂.
参考答案:(12分)(1) 放热 CO(g)+2H2(g)=CH3OH(g)△H=
本题解析:
本题难度:一般
5、填空题 用Cl2生产某些含氯有机物时会产生副产物HC1。利用反应A,可实现氯的循环利用。反应A:4HCl(g) +O2(g) 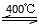 Cl2 (g)+2H2O (g)
Cl2 (g)+2H2O (g)
已知:i.反应A中, 4mol HC1被氧化,放出115.6kJ的热量。
 ii.
ii.
H2O的电子式是_______________。
反应A的热化学方程式是_______________。
③ 断开1 mol H—O 键与断开 1 mol H—Cl 键所需能量相差约为__________kJ,H2O中
H—O 键比HCl中H—Cl键(填“强”或“弱”)_______________。
参考答案:  ①② 4HCl(g) +O2(g)
①② 4HCl(g) +O2(g) 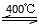 Cl2 (g)+2H2O (g) DH =-115.6 kJ/mol③32 ; 强
Cl2 (g)+2H2O (g) DH =-115.6 kJ/mol③32 ; 强
本题解析:①水的电子式为 ;②注意书写热化学方程式时要标明物质的状态和DH,故反应方程式为4HCl(g)+O2(g)
;②注意书写热化学方程式时要标明物质的状态和DH,故反应方程式为4HCl(g)+O2(g)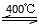 Cl2 (g)+2H2O (g) DH =-115.6 kJ/mol;③;假设断裂1molH-Cl和1molH-O键所需能量分别为X和Y,反应热就是断键吸收的能量和形成化学键所放出的能量的差值,所以有4x+498kJ-2×243kJ-2×2×y=-115.6kJ,解得y-x=31.9,H—O 键比HCl中H—Cl键强,故答案为31.9;强.
Cl2 (g)+2H2O (g) DH =-115.6 kJ/mol;③;假设断裂1molH-Cl和1molH-O键所需能量分别为X和Y,反应热就是断键吸收的能量和形成化学键所放出的能量的差值,所以有4x+498kJ-2×243kJ-2×2×y=-115.6kJ,解得y-x=31.9,H—O 键比HCl中H—Cl键强,故答案为31.9;强.
考点:化学反应中的能量变化
本题难度:一般