|
高考化学知识点总结《化学反应与能量》考点强化练习(2017年押题版)(四)
2017-08-10 02:12:11
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列说法正确的是
A.物质发生化学变化不一定伴随着能量变化
B.硫酸钡、醋酸铵、氨水都是弱电解质
C.向0.1 mol·L-1 Na2CO3溶液中滴加酚酞,溶液变红色
D.在温度、压强一定的条件下,自发反应总是向△H-T△S
|
参考答案:
本题解析:
本题难度:一般
2、实验题 (9分)用右图所示装置进行中和热测定实验,请回答下列问题:
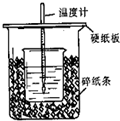
(1)大小烧杯之间填满碎泡沫塑料的作用是 ,从实验装置上看,图中缺少的一种玻璃仪器是 。
(2)使用补全仪器后的装置进行实验,取50mL 0.25mol/L H2SO4溶液与50mL0.55 mol/L NaOH溶液在小烧杯中进行中和反应,三次实验温度平均升高3.4℃。已知中和后生成的溶液的 比热容为4.18J/(g·℃),溶液的密度均为1g/cm3。通过计算可得中和热△H= ,
H2SO4与NaOH反应的热化学方程式为 。
(3)实验中若用60mL0.25mol·L-1H2SO4溶液跟50mL0.55mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等”.“不相等”),所求中和热 (填“相等”.“不相等”),若用50mL0.50mol·L-1醋酸代替H2SO4溶液进行上述实验,测得反应前后温度的变化值会 (填“偏大”、“偏小”、“不受影响”)。
参考答案:(1) 保温、隔热、减少实验过程中的热量损失(1分); 环形玻璃搅拌棒(1分)
(2) -56.8kJ?mol-1 (2分) , H2SO4(aq)+2NaOH(aq)= Na2SO4(aq)+2H2O(l);ΔH=-113.6kJ?mol-1 (2分)
(3) 不相等 (1分) , 相等 (1分) , 偏小 (1分)
本题解析:(1)中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎泡沫塑料的作用是:保温、隔热、减少实验过程中的热量散失,根据量热计的构造可知该装置的缺少仪器是环形玻璃搅拌器;
(2)Q= 3.4°C×4.18J/(g?℃)×100g=1421.2J=1.42KJ,
△H = ;热化学方程式为: ;热化学方程式为:
H2SO4(aq)+2NaOH(aq)= Na2SO4(aq)+2H2O(l);ΔH=-113.6kJ?mol-1
(3)反应放出的热量和所用酸以及碱的量的多少有关,并若用60mL0.25mol?L-1H2SO4溶液跟50mL0.55mol?L-1NaOH溶液进行反应,与上述实验相比,生成水的量增多,所放出的热量偏高,但是中和热的均是强酸和强碱反应生成1mol水时放出的热,中和热相等;又醋酸是弱酸,电离过程吸热,所以用50mL0.50mol?L-1醋酸代替H2SO4溶液进行上述实验,测得反应前后温度的变化值会减小。
考点:中和热的测定。
点评:本题考查学生有关中和热的测定知识,可以根据所学知识进行回答,难度不大。
本题难度:困难
3、填空题 (每空1分,共7分)在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子被称为活化分子。使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ·mol-1表示。请认真观察下图,然后回答问题。
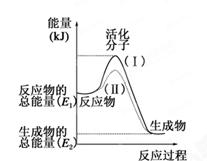
(1)图中所示反应是________(填“吸热”或“放热”)反应。
(2)已知拆开1mol H—H键、1mol I—I、1mol H—I键分别需要吸收的能量为436kJ、151kJ、299kJ。则由1mol氢气和1mol 碘反应生成HI会________(填“放出”或“吸收”)________kJ的热量。在化学反应过程中,是将______转化为________。
(3)下列反应中,属于放热反应的是________,属于吸热反应的是________。
①物质燃烧 ②炸药爆炸 ③酸碱中和反应 ④二氧化碳通过炽热的碳
⑤食物因氧化而腐败 ⑥Ba(OH)2·8H2O与NH4Cl反应 ⑦铁粉与稀盐酸反应
参考答案:(1)放热;(2)放出,11,化学能,热能;(3)① ② ③ ⑤ ⑦ ; ④ ⑥
本题解析:(1)图中所示反应由于反应物的能量高于生成物的能量,所以多余的能量就释放出来,因此该反应是放热反应;(2)发生反应:H2(g)+I2(g)=2HI(g),根据键能关系可知:436kJ+151kJ-2×299kJ=-11KJ,该反应是放热反应,由1mol氢气和1mol 碘反应生成HI会放出11kJ的热量,在化学反应过程中,是将化学能转化为热能;(3) 根据反应的热效应可知:属于放热反应的是① ② ③ ⑤ ⑦ ;属于吸热反应的是④ ⑥。
考点:考查反应热与物质含有的能量、键能 的关系及根据反应的热效应对化学反应的分类的知识。
本题难度:一般
4、选择题 共价键、离子键和范德华力都是微观粒子之间的不同作用力,下列物质:①Na2O2、②SiO2、③NH4Cl、④金刚石、⑤CaH2、⑥白磷,其中含有两种结合力的组合是
A.①③⑤⑥
B.②④⑥
C.①③⑥
D.①②③⑥
参考答案:C
本题解析:①Na2O2中钠离子与过氧根离子之间形成离子键,过氧根离子中氧原子之间形成共价键,含有离子键和共价键两种作用力,故①正确;
②SiO2是原子晶体,只存在共价键,故②错误;
③氯化铵是离子化合物,铵离子与氯离子为离子键,氮与氢之间为共价键,故③正确;
④金刚石是原子晶体,只存在共价键,故④错误;
⑤氢化钙属于离子晶体,钙离子与氢离子之间形成离子键,中只存在离子键,故⑤错误;
⑥白磷属于分子晶体,白磷分子中磷原子之间形成共价键,分子间存在分子间作用力,故⑥正确.
故选:C。
本题难度:一般
5、填空题 用50mL 0.50 mol?L-1盐酸与50mL 0.55 mol?L-1 NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
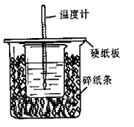
(1)从实验装置上看,图中尚缺少的一种玻璃用品是 。
(2)烧杯间填满碎纸条的作用是 。
(3)大烧杯上如不盖硬纸板,求得的中和热△H绝对值 。(填偏大、偏小、无影响)
参考答案:(6分)(1)环形玻璃搅拌棒(2) 保温、隔热,减小热量散失对实验造成的影响(3)偏小
本题解析:(1)由于反应中需要搅拌,所以从实验装置上看,图中尚缺少的一种玻璃用品是环形玻璃搅拌棒。
(2)该实验中要尽可能的减少热量的损失,所以烧杯间填满碎纸条的作用是保温、隔热,减小热量散失对实验造成的影响。
(3)大烧杯上如不盖硬纸板,则会导致热量的损失,所以求得的中和热△H绝对值偏小。
考点:考查中和热测定的有关实验判断
点评:该题是基础性试题的考查,侧重对学生基础知识的巩固和训练,有利于调动学生的学习兴趣,激发学生的学习积极性。该题主要是常见仪器的选用、实验基本操作为中心,通过是什么、为什么和怎样做重点考查实验基本操作的规范性和准确及灵活运用知识解决实际问题的能力。
本题难度:一般
|