微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 金属钛(Ti)性能优越,被称为继铁、铝制后的“第三金属”.工业上以金红石为原料制取Ti的反应为:
aTiO2+bCl2+cC
?aTiCl4+cCO?…反应Ⅰ
TiCl4+2Mg?Ti+2MgCl2 …反应Ⅱ
关于反应①、②的分析不正确的是( )
①TiCl4在反应Ⅰ中是还原产物,在反应Ⅱ中是氧化剂;
②C、Mg在反应中均为还原剂,被还原;
③在反应Ⅰ、Ⅱ中Mg的还原性大于C,C的还原性大于TiCl4;
④a=1,b=c=2;
⑤每生成19.2?g?Ti,反应Ⅰ、Ⅱ中共转移4.8?mol?e-.
A.①②④
B.②③④
C.③④
D.②⑤
参考答案:①aTiO2+bCl2+cC1173K
本题解析:
本题难度:简单
2、简答题 实验室可用如下反应制取氯气,反应原理如下:2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O
(1)用单线桥表示出上述反应中电子转移的方向和数目
(2)上述反应中氧化剂与还原剂的物质的量比______
(3)15.8g?KMnO4能使多少克HCl被氧化?
(4)产生的Cl2在标准状况下的体积为多少?
参考答案:(1)反应中,化合价升高元素是氯元素,失电子,化合价降低元素是锰元素,得到电子,化合价升高数=化合价降低数=转移电子数=10,单线桥表,反应中电子转移的方向和数目为:
,
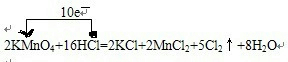
故答案为:
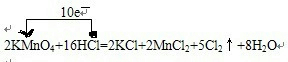
;
(2)反应中,化合价升高元素是盐酸中的氯元素,所以盐酸是还原剂,16mol的盐酸中只有10mol做还原剂,化合价降低元素是锰元素,所以高锰酸钾是氧化剂,氧化剂与还原剂的物质的量比?1:5,故答案为:1:5;
(3)设15.8g?KMnO4能氧化盐酸的质量是x,则根据方程式2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O,可得高锰酸钾和被氧化的盐酸的量之间的关系为:2KMnO4~10HCl,所以
2KMnO4~10HCl
2×158? 365?
15.8g? x
则2×15815.8=365x
解得x=18.25g
答:15.8g?KMnO4能使18.25克HCl被氧化.
(4)设15.8g即0.1molKMnO4氧化盐酸产生的Cl2的物质的量是n,
2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O,
2?5
0.1mol? n
20.1mol=5n
解得n=0.25mol,体积为:0.25mol×22.4L/mol=5.6L.
答:产生的Cl2在标准状况下的体积为5.6L.
本题解析:
本题难度:一般
3、选择题 黑火药的爆炸反应为:2KNO3+S+3C=K2S+N2↑+3CO2↑,其中被还原的元素是( )
A.N
B.C
C.N和C
D.N和S
参考答案:D
本题解析:
本题难度:简单
4、简答题 铁及其化合物在生活、生产中有广泛应用.请回答下列问题:
(1)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料.其中一个反应为:3FeS2+8O2
6SO2+Fe3O4,有3mol FeS2参加反应,转移?mol电子.
(2)氯化铁溶液常用作印刷电路铜板腐蚀剂,反应的离子方程式为?;从腐蚀废液回收得到金属铜,还需要的试剂是?.
(3)与明矾相似,硫酸铁也可用作净水剂,在使用时发现硫酸铁并不能使酸性废水中的悬浮物沉降除去,其原因是?.
(4)钢铁的电化腐蚀简单示意图如图,将该图稍作修改?即可成为钢铁电化学防护的简单示意图,请在虚线框内作出修改,并用箭头标出电子流动方向?.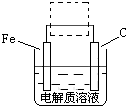
参考答案:(1)3FeS2+8O2?高温?.?6SO2+Fe3O4中,Fe、S元素的化合价升高,O元素的化合价降低,3molFeS2参加反应,由O元素的化合价变化可知,转移的电子为8mol×2×(2-0)=32mol,故答案为:32;
(2)氯化铁溶液与铜反应生成氯化铜和氯化亚铁,该离子反应为2Fe3++Cu=2Fe2++Cu2+,利用置换反应得到,过量铁粉利用盐酸或硫酸除去,则选试剂为铁粉、稀盐酸(稀硫酸),故答案为:2Fe3++Cu=2Fe2++Cu2+;
(3)因酸性废水抑制Fe3+的水解,使其不能生成有吸附作用的Fe(OH)3胶体,则硫酸铁并不能使酸性废水中的悬浮物沉降除去,故答案为:酸性废水抑制Fe3+的水解,使其不能生成有吸附作用的Fe(OH)3胶体;
(4)防止铁被腐蚀,可利用外加电源的阴极保护法,则铁与电源的负极相连,如图
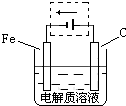
,故答案为:

.
本题解析:
本题难度:一般
5、选择题 下列物质久置于空气中因发生氧化还原反应而变质的是( )
A.氯化钙溶液
B.氯水
C.浓硫酸
D.氯化钠溶液
参考答案:A.氯化钙溶液在空气中难以变质,更不发生氧化还原反应,故A错误;
B.氯水中含有HClO,加光分解生成HCl和氧气,发生氧化还原反应而变质,故B正确;
C.浓硫酸具有吸水性,不发生化学反应,故C错误;
D.氯化钠溶液性质稳定,不发生变质,故D错误.
故选B.
本题解析:
本题难度:简单