微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 1)构成分子晶体的粒子是__________,这类粒子间的作用力一定有__________,还可能有__________。如果分子间作用力只是__________,若以一个分子为中心,其周围通常可以有__________个紧邻的分子,分子晶体的这一特征称为__________。干冰中CO2分子采取的就是这样的堆积方式。若分子内存在吸引电子能力较强、半径较小的__________原子与H原子所形成的共价键,则会形成氢键,氢键不仅具有饱和性,也具有__________。能形成氢键的物质较多,如______________________________等。在冰中,每个水分子与相邻的__________个水分子形成氢键,呈__________立体结构。
(2)在原子晶体中,所有原子都以__________键结合,整个原子晶体是一个三维的__________结构。在金刚石中,C原子采取__________杂化方式,每个C原子与另外__________个C原子以共价键相结合,键角为__________,晶体中最小碳环由__________个C原子构成,且不在同一个平面内。晶体硅的结构与金刚石类似,SiO2的晶体结构可以看作是在晶体硅的Si—Si键之间插入__________原子而形成的,在12 g SiO2晶体中含有化学键的物质的量为 __________mol。
参考答案:(1)分子 范德华力 氢键 范德华力12 分子密堆积 N、O、F 方向性 HF、NH3、H2O、CH3OH等 4 正四面体
(2)共价 共价网状 sp3 4 109°28′ 6 氧 0.8
本题解析:本题考查了分子密堆积和氢键,以及典型的分子晶体和原子晶体的结构。在SiO2晶体中每一个硅原子都与周围的四个氧原子形成了四个硅氧键,并且不存在共用的情况,所以SiO2晶体中化学键的数目为硅原子数目的四倍。12 g SiO2晶体的物质的量是0.2 mol,所以化学键的物质的量为0.8 mol。
本题难度:简单
2、选择题 下列离子晶体中,熔点最低的是(?)
A.NaCl
B.KCl
C.CaO
D.MgO
参考答案:B
本题解析:离子晶体中形成离子键的离子半径越小,电荷数越多,离子键越强,熔沸点越高。所以根据选项中阴阳离子的半径可知,氯化钾的熔点最低,答案选B。
点评:该题是中等难度的试题,也是高考中的常见题型和考点之一,试题基础性强,难易适中,注重能力的培养和训练,有利于培养学生的逻辑推理能力。该题的关键是明确离子晶体熔沸点高低的判断依据。
本题难度:一般
3、简答题 晶胞是晶体中最小的重复单位,数目巨大的晶胞无隙并置构成晶体.NaCl晶体是一个正六面体(如图一).我们把阴、阳离子看成不等径的圆球,并彼此相切(已知a为常数).
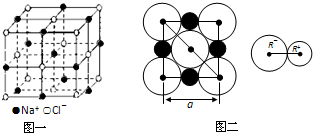
请计算下列问题:
(1)每个晶胞平均分摊______个Na+,______个Cl-.
(2)NaCl晶体中阴阳离子的最短距离为______(用a表示).
(3)NaCl晶体为“巨分子”,在高温下(≥1413℃时)晶体转变成气态团簇分子.现有1molNaCl晶体,加强热使其气化,测得气体体积为11.2L(已折算为标准状况).则此时氯化钠气体的分子式为______.
参考答案:(1)该晶胞中钠离子个数=12×14+1=4,氯离子个数=8×18+6×12=4;
故答案为:4,4;
(2)根据图片二知,NaCl晶体中阴阳离子的最短距离为a的一半即a2;
故答案为:a2;
(3)1mol氯化钠的质量=1mol×58.8g/mol=58.5g,标况下,气体体积为11.2L的氯化钠的物质的量=11.2L22.4L/mol
=0.5mol,M=58.5g0.5mol=117g/mol,所以氯化钠气体的分子式为Na2Cl2;
故答案为:Na2Cl2.
本题解析:
本题难度:一般
4、填空题 五原子分子最常见的空间构型为形_________,如常见的___________和____________,键角都是__________。
参考答案:正四面体;甲烷;四氯化碳;109°28"
本题解析:
本题难度:一般
5、选择题 关于SiO2晶体的叙述中,正确的是 ( )。
A.通常状况下,60 g SiO2晶体中含有的分子数为NA(NA表示阿伏加德罗常数)
B.60 g SiO2晶体中,含有2NA个Si—O键
C.晶体中与同一硅原子相连的4个氧原子处于同一四面体的4个顶点
D.SiO2晶体中含有1个硅原子,2个氧原子
参考答案:C
本题解析:SiO2为原子晶体,晶体中不存在分子,SiO2晶体中一个Si原子与周围4个O原子形成4个Si—O键,一个O原子和两个Si原子形成2个Si—O键所以SiO2晶体中Si、O原子个数比为2:1。在SiO2晶体中一个Si原子和4个O原子构成正四面体构型。所以正确的选项是C。2晶体构型
点评:原子晶体是一个三维的共价键网状结构,不存在单个小分子,是一个“巨分子”。所以其化学式表示原子的个数比,而不是分子式。
本题难度:一般