微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (10分)如图所示是一些晶体的结构,它们分别是NaCl、CsCl、干冰、金刚石、石墨结构中的某一种的某一部分。
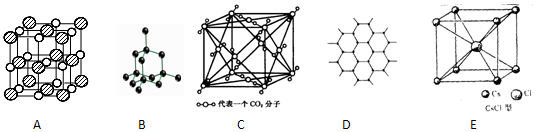
(1)其中代表金刚石的是(填写编号字母,下同)?,其中每个碳原子与?个碳原子最接近且距离相等。属于?晶体。
(2)其中代表石墨的是?,其中每个正六边形占有的碳原子数平均为?个。
(3)其中表示NaCl的是?,每个钠离子周围与它最接近且距离相等的氯离子有?个,每个钠离子周围与它最接近且距离相等的钠离子有?个,每个氯离子周围紧邻的钠离子相连接而成的空间几何体为?。
(4)代表CsCl的是?,它属于?晶体,每个铯离子与?个氯离子紧邻.
参考答案:(1)B? 4?原子晶体(2)D,2。(3)A、6、12 (4)E ,离子,8
本题解析:(1)金刚石是原子晶体,晶体中每个碳原子与4个共价单键对称地与相邻的4个碳原子和。
(2)石墨属于混合型晶体,层和层之间以分子间作用力相连,同一层内每一个碳原子形成3给正六边形,所以每个正六边形占有的碳原子数平均为6÷3=2。
(3)氯化钠是离子晶体,配位数均是6,所以每个钠离子周围与它最接近且距离相等的氯离子有6个。每个钠离子周围与它最接近且距离相等的钠离子有12个。每个氯离子周围紧邻的钠离子相连接而成的空间几何体为正八面体。
(4)氯化铯也是离子晶体,阴阳离子的配位数均是8。
本题难度:一般
2、选择题 下列晶体中,熔点最高的是(?)
A.KF
B来源:91exam .org.MgO
C.CaO
D.NaCl
参考答案:B
本题解析:四种物质形成的晶体均是离子晶体,离子晶体中离子键越强,物质的熔点越高,形成离子键的离子的离子半径越小,所带电荷数越多,离子键越强,熔点越高。阴离子比较大小顺序为O2->F->Cl-,阳离子大小顺序为K+>Ca2+>Na+>Mg2+,所以答案是B。
本题难度:一般
3、选择题 下列有关晶体的叙述中错误的是
A.离子晶体中一定存在离子键
B.原子晶体中,只存在共价键
C.金属晶体的熔沸点均很高
D.稀有气体的原子能形成分子晶体
参考答案:C
本题解析:离子晶体,是指离子间通过离子键结合形成的晶体,故A正确;原子晶体,是指相邻原子之间通过强烈的共价键结合而成的空间网状结构的晶体,故B正确;金属晶体是由金属元素构成的晶体,其熔沸点有的很高,如钨、铂等,有的则很低,如汞、镓等,故C错误;稀有气体的单质都是单原子分子,它们不能形成化学键,只能以微弱的分子间作用力结合,故形成分子晶体,D正确。
点评:晶体结构与性质在高考中考查难度并不大,考生在备考中主要掌握各类晶体的概念及其主要性质。
本题难度:一般
4、填空题 氧元素与多种元素具有亲和力,所形成化合物的种类很多。
(1)氮、氧、氟元素的第一电离能从大到小的顺序为_________。氧元素与氟元素能形成OF2分子,该分子的空间构型为_________________。
(2)根据等电子原理,在NO2+离子中氮原子轨道杂化类型是_________;1 molO22+ 中含有的π键数目为
_________。
(3)氧元素和过渡元素可形成多种价态的金属氧化物,如和铬可生成Cr2O3、CrO3、CrO5等。Cr3+基态核外电子排布式为__________。
(4)钙在氧气中燃烧时得到一种钙的氧化物晶体,其晶体结构如图所示,则该钙的氧化物的化学式为
__________
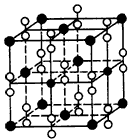
参考答案:(1)F>N>O;V形
(2)sp;2NA
(3)1s22s22p63s23p63d3
(4) CaO2
本题解析:
本题难度:一般
5、选择题 下表所列物质晶体的类型全部正确的一组是
?
| 原子晶体
| 离子晶体
| 分子晶体
|
?A.
| 氮化硅
| 磷酸
| 单质硫
|
?B.
| 单晶硅
| 烧碱
| 白磷
|
?C.
| 金刚石
| 硅铁
| 冰
|
?D.
| 铁
| 尿素
| 冰醋酸
参考答案:B
本题解析:A中磷酸是分子晶体;C中硅铁不是晶体;D中铁是金属晶体,尿素是分子晶体;
本题难度:简单
|