微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
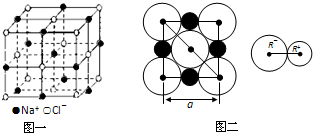
1、简答题 晶胞是晶体中最小的重复单位,数目巨大的晶胞无隙并置构成晶体.NaCl晶体是一个正六面体(如图一).我们把阴、阳离子看成不等径的圆球,并彼此相切(已知a为常数).
请计算下列问题:
(1)每个晶胞平均分摊______个Na+,______个Cl-.
(2)NaCl晶体中阴阳离子的最短距离为______(用a表示).
(3)NaCl晶体为“巨分子”,在高温下(≥1413℃时)晶体转变成气态团簇分子.现有1molNaCl晶体,加强热使其气化,测得气体体积为11.2L(已折算为标准状况).则此时氯化钠气体的分子式为______.
参考答案:(1)该晶胞中钠离子个数=12×14+1=4,氯离子个数=8×18+6×12=4;
故答案为:4,4;
(2)根据图片二知,NaCl晶体中阴阳离子的最短距离为a的一半即a2;
故答案为:a2;
(3)1mol氯化钠的质量=1mol×58.8g/mol=58.5g,标况下,气体体积为11.2L的氯化钠的物质的量=11.2L22.4L/mol
=0.5mol,M=58.5g0.5mol=117g/mol,所以氯化钠气体的分子式为Na2Cl2;
故答案为:Na2Cl2.
本题解析:
本题难度:一般
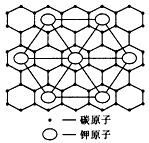
2、选择题 石墨能与熔融金属钾作用,形成石墨间隙化合物,钾原子填充在石墨各层碳原子中。比较常见的石墨间隙化合物是青铜色的化合物,其化学式可写作CxK,其平面图形见下图,则x值为
[? ]
A.8
B.12
C.24
D.60
参考答案:A
本题解析:
本题难度:一般
3、填空题 如图所示的结构为高温超导领域里的一种化合物—钙钛矿晶体结构,该结构是其晶体中具有代表性的最小重复单位。
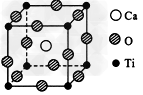
?(1)在该物质的晶体结构中,每个钛离子周围与它 ?最接近且距离相等的钛离子、钙离子各有_____个、?______个。 ?
(2)该晶体结构中,氧、钛、钙的原子个数比是____,该物质的化学式可表示为____。
(3)若钙、钛、氧三元素的相对原子质量分别为a、b、c,晶体结构图中正方体边长(钛原子之间的距离)为d?nm(1?nm=?10-9?m),则该晶体的密度为________g/cm3。
参考答案:(1)6;8?
(2)3:1:1;CaTiO3
(3)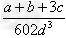
本题解析:
本题难度:一般
4、填空题 现有①NaCl?②干冰?③冰?④Na2O2?⑤白磷?⑥硫磺?⑦MgCl2?⑧金刚石?⑨NH4NO3?⑩SiO2十种物质,按下列要求回答:
(1)以上物质中属于原子晶体的是?。
(2)既有离子键又有共价键的是?。
(3)熔化时不需要破坏化学键的是?。
参考答案:(6分,每空2分)
(1)⑧⑩?(2)④⑨?(3)②③⑤⑥
本题解析:根据构成晶体的微粒判断。
(1)以上物质中属于原子晶体的是金刚石、SiO2。
(2)既有离子键又有共价键的是Na2O2、NH4NO3。
(3)熔化时不需要破坏化学键的是干冰、冰、白磷、硫磺。
点评:对于定义型题的做法是:紧扣定义即可.本题考查了学生对概念的区分、总结能力。
本题难度:一般
5、选择题 NH3分子空间构型是三角锥形,而CH4是正四面体形,这是因为( )
A.NH3分子中N为sp2杂化,CH4分子中C为sp3杂化
B.NH3分子中N原子形成3个杂化轨道,CH4分子中C原子形成4个杂化轨道
C.中心原子N、C都是sp3杂化,但NH3分子中N原子上的一未形成共价键的孤对电子对分子构型有影响,CH4分子中共价键完全相同且分子构型完全对称
D.NH3分子中3个N-H键长大于CH4分子中4个C-H键长
参考答案:C
本题解析:
本题难度:一般