|
高中化学必备知识点《电解池原理》高频考点强化练习(2017年最新版)(十)
2017-08-10 02:20:29
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 如图所示装置中,a、b都是惰性电极,通电一段时间后,b极附近呈蓝色.下列说法正确的是( )
A.x是正极,y是负极
B.x是负极,y是正极
C.a极和Pt产生气体的物质的量相同
D.CuSO4溶液pH值不变,U形管溶液pH值增大
| 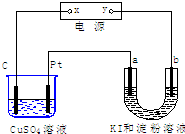
参考答案:a、b都是惰性电极,通电一段时间后,b极附近呈蓝色,则b极上发生2I--2e-=I2,所以b为阳极,可知y为正极,x为负极,故A错误,B正确;
由2Cu2++2H2O?电解?.?2Cu+O2↑+4H+可知酸性增强,溶液的pH减小,pt电极产生氧气,而a电极产生氢气,由电子守恒可知O2~2H2,则气体的物质的量不等,故C、D错误;
故选B.
本题解析:
本题难度:简单
2、填空题 (共11分)工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法有两种。
方法l:还原沉淀法
该法的工艺流程为: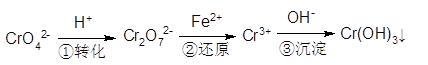
其中第①步存在平衡:2CrO42-(黄色)+2H+ Cr2O72-(橙色)+H2O Cr2O72-(橙色)+H2O
(1)若平衡体系的pH=2,则溶液显 色。
(2)能说明第①步反应达平衡状态的是 。
A.Cr2O2- 7和CrO2- 7的浓度相同 B.2v(Cr2O2- 7)=v(CrO2- 4) C.溶液的颜色不变
(3)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡: Cr(OH)3(s)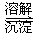 Cr3+(aq)+3OH-(aq) Cr3+(aq)+3OH-(aq)
常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)?c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至 。
方法2:电解法
该法用Fe做电极电解含Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。
(4)用Fe做电极的原因为 。
(5)在阴极附近溶液pH升高的原因是(用电极反应式解释) 。溶液中同时生成的沉淀还有 。
参考答案:(共11分)(1)橙 (1分);(2)C(2分); (3)5(2分);
(4)阳极反应为Fe-2e-=Fe2+(2分);提供还原剂Fe2+(1分)
(5)2H+ +2e-=H2↑(2分);Fe(OH)3 (1分)
本题解析:(1)pH=2说明溶液显酸性,平衡向正反应方向移动,Cr2O72—的浓度会增大,所以溶液显橙色。
(2)在一定条件下的可逆反应里,当正反应速率和逆反应速率相等,反应物的浓度与生成物的浓度不再改变时,该可逆反应就到达化学平衡状态。平衡时浓度不再发生变化,但物质之间的浓度不一定相等或满足某种关系,因此选项A不正确;在任何情况下Cr2O72—和CrO42—的反应速率之比总是满足1:2,因此选项B也不正确;颜色的深浅与浓度有关系,溶液颜色不再改变,这说明Cr2O72—和CrO42—的浓度不再发生改变,因此可以说明反应已经达到化学平衡状态,C正确,答案选C。
(3)由溶度积常数的表达式Ksp=c(Cr3+)·c3(OH—)=10-32可知,当c(Cr3+)=10-5mol/L时,c(OH—)=10-9mol/L,所以pH=5。
(4)Cr2O72—要生成Cr(OH)3沉淀,必需有还原剂,而铁做电极时,在阳极上可以失去电子产生Fe2+,阳极方程式为Fe-2e-=Fe2+。
(5)在电解池中阳离子在阴极得到电子,在溶液中由于H+得电子得能力强于Fe2+的,因此阴极是H+放电,方程式为2H++2e-=H2↑。随着电解的进行,溶液中的H+浓度逐渐降低,水的电离被促进,OH-浓度逐渐升高。由于Fe2+被Cr2O72—氧化生成Fe3+,当溶液碱性达到一定程度时就会产生Fe(OH)3沉淀。
考点:考查外界条件对平衡状态的影响、平衡状态的判断;溶解平衡、电化学原理的应用和计算等
本题难度:困难
3、选择题 用惰性电极电解 和 和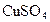 的混合液,且已知 的混合液,且已知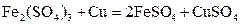 ,下列说法正确的是 ,下列说法正确的是
A.阴极反应式为: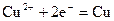 ,当有 ,当有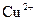 存在时 存在时 不放电 不放电
B.阴极上首先析出铁,然后析出铜
C.阴极上不可能析出铜
D.首先被电解的是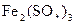 和 和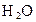 ,后被电解的是 ,后被电解的是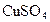 和 和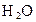
参考答案:D
本题解析:略
本题难度:一般
4、选择题 用惰性电极实现电解,下列说法正确的是
[? ]
A.电解稀硫酸溶液,实质上是电解水,所以溶液pH不变
B.电解稀氢氧化钠溶液,要消耗OH-,所以溶液的pH要减小
C.电解硫酸钠溶液,在阴极上和阳极上析出的产物的物质的量之比为1:2
D.电解硫酸铜溶液,一段时间后,加入适量的CuO能使电解质溶液恢复到电解前的组成和浓度
参考答案:D
本题解析:
本题难度:一般
5、选择题 关于电解NaCl水溶液,下列叙述正确的是( )
A.电解时在阳极得到氯气,在阴极得到金属钠
B.若在阳极附近的溶液中滴入KI溶液,溶液呈棕色
C.若在阴极附近的溶液中滴入酚酞试液,溶液呈无色
D.电解一段时间后,将全部电解液转移到烧杯中,充分搅拌后溶液呈中性
参考答案:A、电解时在阳极是氯离子失电子得到氯气,在阴极是氢离子得到电子生成氢气,故A错误;
B、在阳极附近是氯离子失电子得到氯气,滴入KI溶液,氯气能将碘离子氧化为碘单质而使得溶液呈棕色,故B正确;
C、在阴极阴极是氢离子得到电子生成氢气,该极附近的溶液显碱性,滴入酚酞试液,溶液呈红色,故C错误;
D、电解一段时间后,全部电解液几乎是氢氧化钠,溶液显示碱性,故D错误.
故选B.
本题解析:
本题难度:简单
| 