| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学必备知识点《电解池原理》高频考点强化练习(2017年最新版)(八)
参考答案:D 本题解析:A.pH=1的溶液显酸性,则Fe2+与NO3-发生氧化还原反应,不能大量共存,A错误;B.用惰性电极电解饱和氯化钠溶液的离子方程式为:2Cl- + 2H2O 本题难度:一般 2、填空题 在下图中,甲烧杯中盛有100 mL0.50 mol·L-1 AgNO3溶液,乙烧杯中盛有100 mL 0.25 mol·L-1 CuCl2溶液,A、B、C、D 91eXaM.org 均为质量相同的石墨电极,如果电解一段时间后,发现A极比C 极重1.9g,则
(1)电源E为_________ 极,F为___________ 极。 (2)A极的电极反应式为_________,析出物质__________ mol。 (3)B极的电极反应式为_________,析出气体__________ mL(标准状况)。 (4)C极的电极反应式为________,析出物质___________ mol。 (5)D极的电极反应式为________,析出气体___________ mL(标准状况)。 (6)甲烧杯中滴入石蕊试液,_________极附近变红,如果继续电解,在甲烧杯中最终得到________溶液。 参考答案:(1)负 ;正 本题解析: 本题难度:一般 3、选择题 某学习小组为研究电化学原理,设计下图装置。下列叙述正确的是 参考答案:D 本题解析: 本题难度:一般 4、选择题 如图为阳离子交换膜法电解饱和食盐水原理示意图.?下列说法不正确的是( ) |

参考答案:A、在电解池中,钠离子移向阴极,所以D极是阴极,该极除了产生氢氧化钠以外还会产生氢气,故从E口逸出的气体是H2,故A正确;
B、阴极D极产生大量的氢氧化钠,为了增强导电性,可以从B口加入含少量NaOH的水溶液,故B正确;
C、电解原理方程式2NaCl+2H2O?通电?.?2NaOH+Cl2↑+H2↑,标准状况下每生成22.4L即1molC12,便产生2molNaOH,故C正确;
D、粗盐的提纯要加入氯化钡、氢氧化钠、碳酸钠,但是碳酸钠一定要加在氯化钡的后面,出去过量的钡离子,故D错误.
故选D.
本题解析:
本题难度:简单
5、填空题 铁及其化合物在日常生活、生产中应用广泛.研究铁及其化合物的应用意义重大.
I.水体的净化和污水的处理与铁及其化合物密切相关.
(1)自来水厂常用高铁酸钠(Na2FeO4)改善水质.简述高铁酸钠用于杀菌消毒同时又起到净水作用的原理 .
(2)碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂,在医药上也可用于治疗消化性溃疡出血.工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下: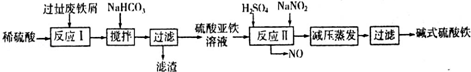
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
 LiFePO4,电池中的固体电解质可传导Li+.试写出该电池充电时的阳极反应式 .
LiFePO4,电池中的固体电解质可传导Li+.试写出该电池充电时的阳极反应式 . 参考答案:Ⅰ.(1)FeO42
本题解析:
本题难度:困难
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点总结《物质的组成.. | |