微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在一定条件下,将1 mol CO和1 mol水蒸气混合后发生如下反应:
CO(气)+H2O(气) CO2(气)+H2(气)若反应达到平衡时测得CO的转化率为21.75%,则平衡混合气体的密度为相同条件下H2密度的?
CO2(气)+H2(气)若反应达到平衡时测得CO的转化率为21.75%,则平衡混合气体的密度为相同条件下H2密度的?
A.5.75倍
B.11.5倍
C.30.67倍
D.46倍
参考答案:B
本题解析:平衡混合气体与氢气的密度比就等于分子量比。此题的关

混合气体的总的物质的量。根据质量守衡定律,平衡混合气的质量应等于起始的1molCO和1mol水蒸气之和。根据化学方程式反应前后气体的总的物质的量不变,无论化学平衡怎样移动,平衡混合气的总的物质的

为相同条件下H2密度为11.5倍。
本题难度:一般
2、选择题 一定温度下,向a L 密闭容器中加入2 mol NO2(g),发生如下反应:2NO2 2NO+O2,此反应达到平衡状态的标志是(?)
2NO+O2,此反应达到平衡状态的标志是(?)
A.混合气体的密度不再变化
B.混合气体的颜色变浅
C.混合气体中NO2、NO、O2的物质的量之比为2∶2∶1
D.单位时间内生成2 n mol NO同时生成2 n mol NO2
参考答案:D
本题解析:a L密闭容器即体积不变,所以气体密度不随反应变化而变;颜色不再变化是平衡标志;n(NO2)∶n(NO)∶n(O2)=2∶2∶1,是各物质变化量的比值,与平衡无关;D选项即为v(正)=v(逆)。
本题难度:简单
3、选择题 25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:
Sn(s)+Pb2+(aq) Sn2+(aq)+Pb(s),平衡时体系中c(Pb2+)和c(Sn2+)的浓度分别为
Sn2+(aq)+Pb(s),平衡时体系中c(Pb2+)和c(Sn2+)的浓度分别为
0.1 mol/L和0.2mol/L。下列判断正确的是
A.25℃时,该反应的平衡常数K=0.2
B.往平衡体系中加入金属铅后,c(Pb2+)增大
C.往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变大
D.升高温度,平衡体系中c(Pb2+)增大,说明该反应△H>0
参考答案:C
本题解析:A项:应为K=2,故错;B项:加入固体的量,不影响化学平衡移动,故错;D项:正反应为放热发应,△H<0,故错。故选C。
点评:本题考查的是化学平衡移动原理及平衡常数的计算。难度大。注意化学平衡知识的学习。
本题难度:简单
4、选择题 下列事实不能用勒沙特列原理解释的是
A.新制的氯水在光照条件下颜色变浅
B.加入催化剂有利于氨的氧化反应
C.实验室中常用排饱和食盐水的方法收集氯气
D.工业上生产硫酸的过程中使用过量的空气以提高二氧化硫的利用率
参考答案:B
本题解析:略
本题难度:一般
5、填空题 化学学科中的平衡理论主要包括:化学平衡、电离平衡和水解平衡三种,且均符合勒夏特列原理。请回答下列问题:
Ⅰ、在恒容密闭容器中,发生反应3A(g)+B(g) 2C(g) ΔH=Q kJ/mol。回答下列问题:
2C(g) ΔH=Q kJ/mol。回答下列问题:
(1)写出该反应平衡常数的表达式__________。
(2)下列各项能作为判断该反应达到化学平衡状态的依据是________(填序号)。
① v(A)=3v(B)?②混合气体的密度保持不变
③有3 mol A消耗的同时有1 mol B生成 ④C的浓度保持不变
(3)根据实验测得的数据可知,温度越高该反应的化学平衡常数越大,则Q______0(填“大于”或“小于”)。
Ⅱ、(1)室温下,取pH=2的盐酸和醋酸溶液各100 mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示。则图中表示醋酸溶液中pH变化曲线的是________(填 “a”或“b”)。设盐酸中加入Zn质量为m1,醋酸溶液中加入的Zn质量为m2,则m1________m2(选填“<”、“=”或“>”)。
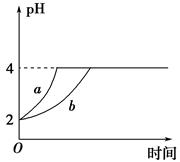
(2)若室温下pH=2的盐酸和醋酸溶液各 100 mL,分别加水稀释后使pH=4,设盐酸中加入水的体积为V1,醋酸溶液中加入的水的体积为V2,则 V1______V2(填“<”“=”或“>”)。
Ⅲ、常温下,浓度均为0.1 mol/L 的下列六种溶液的pH如下表:
溶质
| CH3COONa
| NaHCO3
| Na2CO3
| NaClO
| NaCN
| C6H5ONa
|
pH
| 8.8
| 9.7
| 11.6
| 10.3
| 11.1
| 11.3
|
(1)上述盐溶液中的阴离子,结合H+能力最强的是?
(2)根据表中数据判断,浓度均为0.01 mol/L 的下列五种物质的溶液中,酸性最强的是_______ (填编号) ; 将各溶液分别稀释100倍, pH变化最小的是??(填编号) 。
A.HCN? B.HClO? C.C6H5OH? D.CH3COOH? E.H2CO3
(3)据上表数据,请你判断下列反应不能成立的是 ?(填编号)。
A.CH3COOH+ Na2CO3=NaHCO3+CH3COONa
B.CH3COOH+NaCN=CH3COONa+HCN
C.CO2+H2O+2C6H5 ONa=Na2CO3+2C6H5OH
Ⅳ、已知:ZnCl2·xH2O易溶于水,且其浓的水溶液呈较强酸性;SOCl2 (氯化亚砜)极易和水发生如下反应:SOCl2+H2O=SO2+2HCl。实验室中制取无水氯化锌采用ZnCl2·xH2O与SOCl2混合加热的方法。试回答:
SOCl2的作用是___________________________________。
参考答案:Ⅰ.⑴K=c2(C)/c3(B)c(A)⑵ ③④ ⑶大于。
Ⅱ.(1)?b ,?<?。(2)?<?。
Ⅲ.①?CO32 -?,②?D?,?C?。 ③?C 。
Ⅳ?夺去ZnCl2·xH2O中的水,同时生成HCl,它可以抑制ZnCl2的水解?。
本题解析:Ⅰ.⑴反应3A(g)+B(g) 2C(g)的平衡表达式为K=c2(C)/c3(B)c(A);
2C(g)的平衡表达式为K=c2(C)/c3(B)c(A);
(2)当该反应达到平衡时, v(A)=3v(B)不能作为其标志,因为整个过程都是v(A)=3v(B),混合气体的密度保持不变,不能作为其达到平衡的标志,因为整个过程中混合气体的密度保持不变;有3 mol A消耗的同时有1 mol B生成和C的浓度保持不变可以作为判断其达到平衡的标志,所以本题的答案为③④;
(3)温度越高该反应的化学平衡常数越大,根据勒夏特勒原理,可以知道该反应为吸热反应,所以Q大于0;
Ⅱ(1)pH=2的盐酸和醋酸,相同体积的条件下,醋酸的物质的量远远大于盐酸的物质的量,但当两者与锌反应时,由于醋酸不断电离出氢离子,所以比较慢达到pH=4,所以图中表示醋酸溶液中pH变化曲线的是b,且醋酸消耗的锌的质量较大;
(2)pH=2的盐酸和醋酸,相同体积的条件下,醋酸的物质的量远远大于盐酸的物质的量,所以加水稀释后使pH=4,醋酸所用水的体积较大;
Ⅲ(1)上述盐溶液中的阴离子,pH越大则说明结合H+的能力越大,所以结合H+能力最强的是CO32 - ;盐溶液中的阴离子,pH越小,说明其酸性越强,所以CH3COOH 的酸性最强;苯酚在水中的溶解度很小,所以将各溶液分别稀释100倍, pH变化最小的是苯酚;(3)根据强酸制备弱酸的原理,可以知道CO2+H2O+2C6H5 ONa=Na2CO3+2C6H5OH不能够成立,因为碳酸根的酸性比苯酚弱,故产物不能出现Na2CO3,所以答案选择C;
Ⅳ因为SOCl2 (氯化亚砜)极易和水发生如下反应:SOCl2+H2O=SO2+2HCl,产生的HCl有利于抑制锌离子的水解,且可以抢夺ZnCl2·xH2O中的水,即SOCl2的作用是夺去ZnCl2·xH2O中的水,同时生成HCl,它可以抑制ZnCl2的水解。
点评:本题综合考查了化学平衡、强弱电解质、盐类水解的相关知识,该题综合性强,涉及的范围比较广,该题有一定的难度。
本题难度:一般