微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在一定温度下将1mol CO和3mol水蒸气放在密闭的容器中发生下列反应:CO(g)+H2O(g)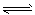 CO2(g)+H2(g)达到平衡后,测得CO2为0.75mol,再通入6mol水蒸气,达到新的平衡后,CO2和H2的物质的量之和为
CO2(g)+H2(g)达到平衡后,测得CO2为0.75mol,再通入6mol水蒸气,达到新的平衡后,CO2和H2的物质的量之和为
[? ]
A.1.2mol
B.1.5mol
C.1.8mol
D.2.5mol
参考答案:C
本题解析:
本题难度:一般
2、填空题 (12分)现有反应:mA(g)+nB(g) pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
(1)该反应的逆反应为_________热反应,且m+n_________p(填“>”“=”“<”)。
(2)减压时,A的质量分数_________。(填“增大”“减小”或“不变”,下同)
(3)若加入B(体积不变),则A的转化率_________。
(4)若升高温度,则平衡时B、C的浓度之比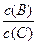 将_________。
将_________。
(5)若加入催化剂,平衡时气体混合物的总物质的量____?_____。
(6 )若B
)若B 是有色物质,A、C均无色,则加入C(体积不变)时混合物颜色______?_;而维持容器内压强不变,充入氖气时,混合物颜色____?___(
是有色物质,A、C均无色,则加入C(体积不变)时混合物颜色______?_;而维持容器内压强不变,充入氖气时,混合物颜色____?___( 填“变深”“变浅”或“不变”)。
填“变深”“变浅”或“不变”)。
参考答案: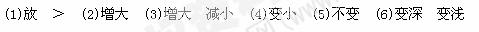
本题解析:略
本题难度:一般
3、选择题 恒温恒容的三个密闭容器,N2(g)+3H2(g) 2NH3(g)?△H=-92.4 kJ/mol。实验测得起始、平衡时的有关数据如下表。下列叙述正确的是
2NH3(g)?△H=-92.4 kJ/mol。实验测得起始、平衡时的有关数据如下表。下列叙述正确的是
容器
编号
| 起始时各物质物质的量/mol
| 平衡时反应中的能量变化
|
N2
| H2
| NH3
|
①
| 1
| 3
| 0
| 放出热量a kJ
|
②
| 2
| 3
| 0
| 放出热量b kJ
|
③
| 2
| 6
| 0
| 放出热量c kJ
|
A.放出热量a<b<92.4
B.三个容器内反应的平衡常数③>①>②
C.N2的转化率①<②
D.达平衡时氨气的体积分数①>③
参考答案:A
本题解析:根据表中数据可知,②相当于是在①的基础上增大氮气的浓度,平衡向正反应方向进行,氢气的转化率增大,A正确。但氮气的转化率降低,C不正确;温度相同,平衡常数不变,B不正确;③和①相比,相当于是在①的基础上增大压强,平衡向正反应方向移动,氨气的体积分数增大,D不正确,答案选A。
点评:在判断①和③时可以利用等效平衡进行。所谓等效平衡是指外界条件相同时,同一可逆反应只要起始浓度相当,无论经过何种途径,都可以达到相同的平衡状态。等效平衡的判断及处理一般步骤是:进行等效转化——边倒法,即按照反应方程式的计量数之比转化到同一边的量,与题干所给起始投料情况比较。恒温恒容下对于反应前后气体体积发生变化的反应来说(即△n≠0的体系):等效转化后,对应各物质起始投料的物质的量与原平衡起始态相同。显然该题中①和③的平衡是不等效的,所以需要把③中反应物的均分2份,然后在压缩即可与①进行对比。
本题难度:一般
4、简答题 某温度下,可逆反应2NO2?
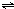
?N2O4达平衡时,测得混合气体的密度是相同条件下氢气的36倍,求:
(1)此混合气体中NO2与N2O4的物质的量之比.
(2)若反应温度与容器容积不变,开始输进的是N2O4气,从逆向反应达平衡时,求N2O4的转化率.
参考答案:(1)混合气体的密度是相同条件下氢气的36倍,所以混合气体的平均相对分子质量为36×2=72,
利用十字交叉法计算NO2与N2O4的物质的量之比:
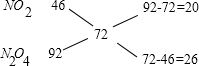
所以n(NO2):n(N2O4)=20:26=10:13,
答:混合气体中NO2与N2O4的物质的量之比为10:13;
(2)与原平衡完全等效,平衡时各组分的物质的量与原平衡相同.
平衡时混合气体中NO2与N2O4的物质的量之比为10:13,令NO2与N2O4的物质的量分别为10mol、13mol.
? ?N2O4
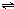
?2NO2?
开始(mol):13+5=18? 0
变化(mol):5? 10-0=10
平衡(mol):13? 10
所以N2O4的转化率为5mol18mol×100%=27.8%,
答:N2O4的转化率为27.8%.
本题解析:
本题难度:一般
5、选择题 一定温度下,将足量固体A加入恒容真空容器中发生可逆反应:2A(s) 2B(g)+C (g),下列能说明反应已达平衡状态的是
2B(g)+C (g),下列能说明反应已达平衡状态的是
A.混合气体的密度保持不变? B.容器内B、C的浓度之比为2∶1
C.B的生成速率等于C的消耗速率?D.气体的体积分数保持不变
参考答案:A
本题解析:在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态A、密度是混合气的质量和容器容积的比值,在反应过程中容器容积不变,反应物A是固体,只要反应没有达到平衡状态,气体的质量就会不变,当达到了平衡状态后,气体的质量不再发生变化,此时气体的密度不变,故A正确;B、根据方程式可知,无论是否达到平衡状态,B、C的浓度之比始终是2:1,故容器内B、C的浓度之比为2:1无法判断是否达到了平衡状态,故B错误;C、由于B和C的化学计量数不相等,达到平衡状态时,B的生成速率等于2倍的C的消耗速率,故C错误;D、体系中气体只有B、C,无论是否达到了平衡状态,体积比始终是2:1,体积分数始终不变,故D错误,所以答案选A。
本题难度:一般