微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 配制一定物质的量浓度的溶液,下列情况会使配制结果偏高的是?
A.容量瓶中原有少量蒸馏水
B.定容时仰视容量瓶的刻度线观察液面
C.未洗涤烧杯以及玻璃棒
D.定容时俯视容量瓶的刻度线观察液面
参考答案:D
本题解析:析:根据c= 分析操作对溶质的物质的量或对溶液的体积的影响判断.
分析操作对溶质的物质的量或对溶液的体积的影响判断.
解答:解:A、容量瓶中原来含有少量蒸馏水,无影响,浓度不变,故A错误;
B、定容时仰视容量瓶的刻度线观察液面,溶液的体积偏大,浓度偏小故B错误;
C、未洗涤烧杯和玻璃棒,溶质的质量减少,浓度偏低,故C错误;
D、定容时俯视刻度线观察液面、溶液的体积偏小,浓度偏大,故D正确;
故选D.
本题难度:简单
2、计算题 用0.05mol/L的Ba(OH)2溶液,滴定盐酸和硫酸的混合液,下图分别是Ba(OH)2溶液加入量和pH值,以及沉淀量的关系,求原混合液中H+、Cl-、SO42-的物质的量浓度。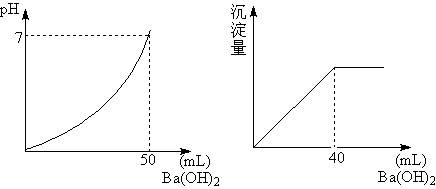
参考答案:[H+]=1mol/L,[Cl—]=0.2mol/L,[SO42-]=0.4mol/L。
本题解析:关键是看懂图象,左图为加入50mLBa(OH)2,恰好将混酸完全中和。右图是滴入Ba(OH)4 40mL,将混酸中SO42-完全沉淀,然后依据这两点的离子反应所决定的量解析。由左图看,滴入Ba(OH)2前混酸pH=0,所以[H+]=1mol/L;
由图象可知:加入50mLBa(OH)2,恰好将混酸完全中和。
设混酸体积为x,则有:1mol/L×x=0.05mol/L×2×0.05L,x=0.005L 。 由图可知,滴入Ba(OH)4 40mL,将混酸中SO42-完全沉淀:
[SO42-]= ? =0.4mol/L
=0.4mol/L
[HCl]=  =0.2mol/L
=0.2mol/L
所以原混合液[H+]、[Cl—]、[SO42-]分别为:1mol/L, 0.2mol/L, 0.4mol/L。
本题难度:简单
3、选择题 用NA表示阿伏加德罗常数的值,下列叙述正确的是
A.24g NaH中阴离子所含电子总数为NA
B.标准状况下,22.4 L苯中含有C—H键数目为6NA
C.在碳酸钠溶液中,若c(CO32-)="1" mol?L-1,则c(Na+)="2" mol?L-1
D.通过MnO2催化使H2O2分解,产生32gO2时转移电子数为2NA
参考答案:D
本题解析:A、应该含电子总数为2NA,错误;B、标准状况时,苯为液体,无法计算对应的物质的量,错误;C、溶液中CO32-会发生水解,若c(CO32-)="1" mol?L-1,则c(Na+)〉2 mol?L-1,错误;D、32g O2时转移电子数为2NA,正确。
考点定位:考查了阿伏伽德罗常数,溶液例子水解,电子转移等知识。
本题难度:一般
4、选择题 1 mol/L NaCl溶液表示( )
A.1mol NaCl溶于1L水中
B.58.5g NaCl溶于 941.5g水中
C.溶液中含1mol NaCl
D.1L溶液里含NaCl 58.5g