微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (16分)已知氯气的漂白作用实际上是氯气与水反应生成的次氯酸的漂白作用。为 了探究二氧化硫的漂白作用到底是二氧化硫本身还是二氧化硫与水作用的产物,某学习小组设计了如下装置来进行实验。请回答相关问题。
了探究二氧化硫的漂白作用到底是二氧化硫本身还是二氧化硫与水作用的产物,某学习小组设计了如下装置来进行实验。请回答相关问题。
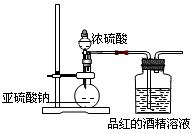
(1)为了探究干燥的SO2能不能使品红褪色,某同学设计了如图所示实验装置,请指出实验装置图设计中的不合理之处。
①?;? ②?.
(2)按照修改后的装置,实验中控制二氧化硫以大约每秒3个气泡的速度通过品红的酒
精溶液时,经过一小时后,品红仍不褪色。这说明品红褪色的原因不是二氧化硫直接导
致。为此,SO2能使品红的水溶液褪色的可能微粒有?。
(3)甲同学实验如下:取等量、相同浓度的品红水溶液于两支试管中,再分别加入少量
亚硫酸钠固体和亚硫酸氢钠固体,两支试管中的品红都褪色,对此,他得出结论:使品
红褪色的微粒是HSO3-和SO32-,不是H2SO3。你认为他的结论是否正确?,其理由
是?。
(4)为了进一步探究,乙组同学做了如下实验:分别取相同浓度的品红水溶液各20ml于两只小烧杯中,两只烧杯中同时一次性各加入20ml 0.1mol/L的亚硫酸钠,20ml 0.1mol/L的亚硫酸氢钠溶液,发现加入亚硫酸钠溶液的品红褪色较快。
①微粒浓度与褪色快慢关系,请用“多”或“少”填写“?”内容。
同浓度溶液
| SO32-
| HSO3-
| H2SO 3 3
| 褪色速度
|
Na2SO3溶液
| 多
| 少
| 少
| 快
|
NaHSO3溶液
| 较上面?
| 较上面?
| 较上面?
| 慢
|
②根据实验和分析,得出的结论是?。
参考答案:(16分)(1)①二氧化硫没有干燥(或缺少二氧化硫的干燥装置);(2分)
②没有尾气吸收装置?(2分)
(2)H2SO3、HSO 、SO
、SO (3分)
(3分)
(3)不正确(1分),因亚硫酸根离子和亚硫酸氢根离子都会水解生成亚硫酸。(3分)
(4)①(3分)
同浓度溶液
SO
HSO
H2SO3
褪色速度
Na2SO3溶液
多
少
很少
快
Na HSO3溶液
较上面少
较上面多
较上面多
慢
本题解析:略
本题难度:一般
2、实验题 (5分)为了探究乙酸乙酯水解的条件,做了如下实验
步骤一:取三支相同的试管编号为1、2、3,各试管内依次加入下列药品
试管编号
| 1
| 2
| 3
|
加入的药品和数量
| 4 mL蒸馏水
| 4 mL 蒸馏水
+3滴浓H2SO4
| 4 mL 蒸馏水
+3滴NaOH浓溶液
|
3滴甲基橙试剂
2 mL乙酸乙酯
| 3滴甲基橙试剂
2 mL乙酸乙酯
| 3滴石蕊溶液
2 mL乙酸乙酯
|
步骤二:将三支试管振荡后,静置,插入热水浴(约75℃)中,加热约5 min,加热过程中不再振荡。
回答下列问题:
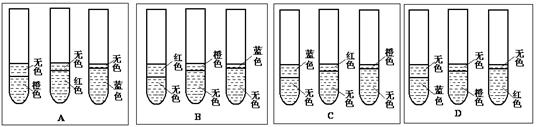
(1)根据你已有的对乙酸乙酯反应条件的认识,该实验预期可观察到的现象是下图中的?。
(2)该实验对反应温度的控制较为严格,若温度过高时,产生的主要问题是?。
(3)在步骤二中,振荡试管后可观察到液体稍显浑浊,其原因是?。
(4)按所设步骤实验反应速率较慢,其主要原因是?。
(5)在实际操作中,针对(4)中的原因进行改进后,预期的现象仍不明显,有人又将该实验作如下改进
试管编号
| 1
| 2
| 3
|
加入的药品和数量
| 4 mL饱和食盐水
| 4 mL饱和食盐水
+3滴浓H2SO4
| 4 mL饱和食盐水
+3滴NaOH浓溶液
|
3滴甲基橙试剂
2 mL乙酸乙酯
| 3滴甲基橙试剂
2 mL乙酸乙酯
| 3滴石蕊溶液
2 mL乙酸乙酯
|
实验现象和预期的完全一致。请分析这一改进的主要作用是?。
参考答案:(5分)
(1)A?(1分)
(2)高温下乙酸乙酯挥发 (1分)?
(3) 乙酸乙酯在水溶液中形成乳浊液?(1分)
(4)有机层和水层接触面太小(1分)
(5)乙酸乙酯在水中和电解质溶液中溶解度相差较大,改用饱和食盐水后大大减少了乙酸乙酯的溶解。(1分)
本题解析:(1)实验1中的乙酸乙酯不水解,所以下层仍是橙色,上层为无色的乙酸乙酯;实验2中加入稀硫酸,乙酸乙酯水解后的溶液呈酸性,酸使甲基橙变红色,所以下层是红色,上层是无色;实验3加入氢氧化钠,乙酸乙酯水解后的溶液呈碱性,所以碱遇石蕊变蓝色,下层是蓝色,上层是无色,答案选A。
(2)乙酸乙酯的沸点较低,温度过高,造成乙酸乙酯的挥发损失;
(3)乙酸乙酯微溶于水,振荡后形成乳浊液使溶液显浑浊;
(4)乙酸乙酯微溶于水,所以有机层和水层接触面太小,反应速率慢;
(5)改进的实验与原来相比,差别在于加入了饱和食盐水,说明乙酸乙酯在水中和电解质溶液中溶解度相差较大,改用饱和食盐水后大大减少了乙酸乙酯的溶解。
本题难度:一般
3、实验题 化学是一门以实验为基础的自然科学,化学实验在化学学习中具有极其重要的作用。某研究性学习小组用如下图装置进行铜与浓硫酸反应的实验研究。
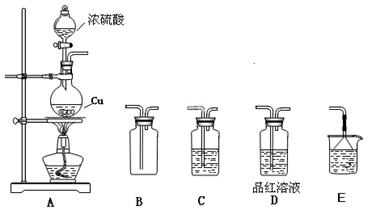
(1)装置A中发生反应的化学方程式?;
(2)若要使B 中收集满干燥的SO2气体(并证实B中已收集满),则上述装置的连接顺序为:?接?接??接?接?(用字母表示);
(3)C 中盛放的试剂是?,证明B 中已收集满SO2的现象是?;
(4)待烧瓶中充分反应后,同学们发现铜有剩余,经检测发现硫酸也有剩余。检验硫酸有剩余的方法是?___________________;
(5)在不补充浓硫酸的前提下,为使铜进一步溶解,可向烧瓶中加入? ________(填序号)。① 盐酸 ?② FeSO4? ③ Fe2O3? ④KNO3
参考答案:(1)Cu+2H2SO4(浓)△CuSO4+SO2↑+2H2O?(2分)
(2)ACBDE?(2分) (3)浓硫酸、D中品红溶液褪色?(各1分)
(4)取反应后的溶液,加入锌片,若有气泡产生,则硫酸有剩余。(其它合理答案均给分) (2分)?(5)③④?(2分)
本题解析:略
本题难度:一般
4、填空题 开源节流是应对能源危机的重要举措.
(1)下列做法有助于能源“开源节流”的是______(填字母).
a.大力开采煤、石油和天然气以满足人们日益增长的能源需求
b.大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源
c.开发太阳能、水能、风能、地热等新能源、减少使用煤、石油等化石燃料
d.减少资源消耗,增加资源的重复使用、资源的循环再生
(2)氢能是理想的清洁能源.下列制氢的方法中,最节能的是______(填字母).
a.电解水制氢:2H2O
2H2↑+O2↑
b.高温使水分解制氢:2H2O2H2↑+O2↑
c.太阳光催化分解水制氢:2H2O2H2↑+O2↑
d.天然气制氢:CH4+H2OCO+3H2
(3)利用MnFe2O4通过两步反应使水分解制氢气,第一步反反应为:MnFe2O4MnFe2O4-X+O2,则第二步反应的化学方程式为______(条件不写).
(4)如图是以SO2、I2、H2O为原料,利用核能使水分解制氢气的一种流程.
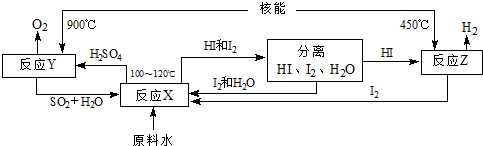
反应X的化学方程式为______,该流程中循环使用的原料有______.从理论上讲,该流程中,1mol原料水制得______molH2.
参考答案:(1)只要能减少自然资源的运用都属于“开源节流”.
a、不能减少自然资源的运用,故错误.
b、c、d能减少自然资源的运用,故正确.
故选bcd.
(2)最节能的方法是运用太阳能,高温、电解都需要其它自然资源,故选C.
(3)第二步MnFe2O4-X和水反应生成MnFe2O4和氢气,反应方程式为MnFe2O4-X+xH20=MnFe2O4+xH2↑.
故答案为:MnFe2O4-X+xH20=MnFe2O4+xH2↑.
(4)在100-120℃条件下,碘、二氧化硫和水反应生成硫酸和氢碘酸,反应方程式为SO2+I2+2H2O=2HI+H2SO4;根据流程图知,该流程中循环使用的原料有SO2、I2;一个H2O中含有2个氢原子,所以水分子和氢分子的个数之比是1:1,故从理论上讲,该流程中,1mol原料水制得1mol氢气.
故答案为:SO2+I2+2H2O=2HI+H2SO4;SO2、I2;1.
本题解析:
本题难度:一般
5、实验题 (9分)有两个实验小组的同学探究一氧化碳、二氧化硫与过氧化钠的反应。请回答下列问题:
(1)第一小组同学设计如图装置进行实验。通入SO2气体,将带余烬的木条插入试管C中,木条复燃。

甲同学认为Na2O2与SO2反应生成了Na2SO3和O2,则反应的化学方程式为___________________________。
乙同学认为Na2O:与SO2反应除了生成Na2SO3和O2外,还有Na2SO4生成。为检验是否有Na2SO4生成,该同学设计了如下方案:

你认为乙同学的方案是否合理____________(答“是”或“否”);请简要说明两点理由:
①__________________________________________________________________________
②__________________________________________________________________________.
(2)第二小组同学利用下图中的有关装置(固定装置及胶管略去)验证CO气体能否与Na2O2反应。已知:H2C2O4  ?CO2↑+CO↑+H2O
?CO2↑+CO↑+H2O
(乙二酸)?

若CO能够与Na2O2发生反应,则预测反应产物为______________________;验证该产物可选择的试剂是___________________________________________________。
上述实验中选择的最简单的装置接口连接顺序为_________________________.
参考答案:(1) ;否(1分)
;否(1分)
①稀HNO3可以把BaSO3氧化为BaSO4(1分)
②若反应后的固体有Na2O2残留,溶于水后可把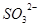 氧化为
氧化为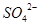 (1分)
(1分)
(2)Na2CO3(1分);稀 (或稀HC1)和澄清石灰水(1分);a b c f(2分)
(或稀HC1)和澄清石灰水(1分);a b c f(2分)
本题解析:(1)仿照CO2与过氧化钠的反应方程式可写出或直接配平:
(2)本质是检验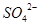 的存在,该方案明显不合理:
的存在,该方案明显不合理:
①原溶液中即使没有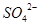 ,但
,但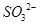 与加入的氯化钡溶液形成的BaSO3可被稀HNO3氧化为BaSO4
与加入的氯化钡溶液形成的BaSO3可被稀HNO3氧化为BaSO4
②若反应后的固体有Na2O2残留,溶于水后可把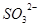 氧化为
氧化为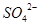 ,最终也可以得到同样的现象
,最终也可以得到同样的现象
正确的检验过程是:先加入过量盐酸,再加入氯化钡溶液,如果有白色沉淀生成,则可证明有Na2SO4存在
(2)CO被Na2O2氧化:Na2O2+CO=Na2CO3
Na2CO3属于碳酸盐,可用酸与其反应产生CO2,再通入澄清石灰水中,看是否有浑浊出现;
由于H2C2O4  ?CO2↑+CO↑+H2O,产生的CO中含有CO2,故应先用碱液吸收CO2,则装置接口的连接顺序为:a b c f
?CO2↑+CO↑+H2O,产生的CO中含有CO2,故应先用碱液吸收CO2,则装置接口的连接顺序为:a b c f
本题难度:一般