微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (16分)已知氯气的漂白作用实际上是氯气与水反应生成的次氯酸的漂白作用。为 了探究二氧化硫的漂白作用到底是二氧化硫本身还是二氧化硫与水作用的产物,某学习小组设计了如下装置来进行实验。请回答相关问题。
了探究二氧化硫的漂白作用到底是二氧化硫本身还是二氧化硫与水作用的产物,某学习小组设计了如下装置来进行实验。请回答相关问题。
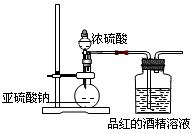
(1)为了探究干燥的SO2能不能使品红褪色,某同学设计了如图所示实验装置,请指出实验装置图设计中的不合理之处。
①?;? ②?.
(2)按照修改后的装置,实验中控制二氧化硫以大约每秒3个气泡的速度通过品红的酒
精溶液时,经过一小时后,品红仍不褪色。这说明品红褪色的原因不是二氧化硫直接导
致。为此,SO2能使品红的水溶液褪色的可能微粒有?。
(3)甲同学实验如下:取等量、相同浓度的品红水溶液于两支试管中,再分别加入少量
亚硫酸钠固体和亚硫酸氢钠固体,两支试管中的品红都褪色,对此,他得出结论:使品
红褪色的微粒是HSO3-和SO32-,不是H2SO3。你认为他的结论是否正确?,其理由
是?。
(4)为了进一步探究,乙组同学做了如下实验:分别取相同浓度的品红水溶液各20ml于两只小烧杯中,两只烧杯中同时一次性各加入20ml 0.1mol/L的亚硫酸钠,20ml 0.1mol/L的亚硫酸氢钠溶液,发现加入亚硫酸钠溶液的品红褪色较快。
①微粒浓度与褪色快慢关系,请用“多”或“少”填写“?”内容。
同浓度溶液
| SO32-
| HSO3-
| H2SO 3 3
| 褪色速度
|
Na2SO3溶液
| 多
| 少
| 少
| 快
|
NaHSO3溶液
| 较上面?
| 较上面?
| 较上面?
| 慢
|
②根据实验和分析,得出的结论是?。
2、实验题 (5分)为了探究乙酸乙酯水解的条件,做了如下实验
步骤一:取三支相同的试管编号为1、2、3,各试管内依次加入下列药品
试管编号
| 1
| 2
| 3
|
加入的药品和数量
| 4 mL蒸馏水
| 4 mL 蒸馏水
+3滴浓H2SO4
| 4 mL 蒸馏水
+3滴NaOH浓溶液
|
3滴甲基橙试剂
2 mL乙酸乙酯
| 3滴甲基橙试剂
2 mL乙酸乙酯
| 3滴石蕊溶液
2 mL乙酸乙酯
|
步骤二:将三支试管振荡后,静置,插入热水浴(约75℃)中,加热约5 min,加热过程中不再振荡。
回答下列问题:
(1)根据你已有的对乙酸乙酯反应条件的认识,该实验预期可观察到的现象是下图中的?。
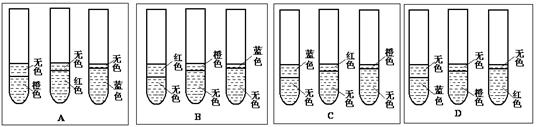
(2)该实验对反应温度的控制较为严格,若温度过高时,产生的主要问题是?。
(3)在步骤二中,振荡试管后可观察到液体稍显浑浊,其原因是?。
(4)按所设步骤实验反应速率较慢,其主要原因是?。
(5)在实际操作中,针对(4)中的原因进行改进后,预期的现象仍不明显,有人又将该实验作如下改进
试管编号
| 1
| 2
| 3
|
加入的药品和数量
| 4 mL饱和食盐水
| 4 mL饱和食盐水
+3滴浓H2SO4
| 4 mL饱和食盐水
+3滴NaOH浓溶液
|
3滴甲基橙试剂
2 mL乙酸乙酯
| 3滴甲基橙试剂
2 mL乙酸乙酯
| 3滴石蕊溶液
2 mL乙酸乙酯
|
实验现象和预期的完全一致。请分析这一改进的主要作用是?。
3、实验题 化学是一门以实验为基础的自然科学,化学实验在化学学习中具有极其重要的作用。某研究性学习小组用如下图装置进行铜与浓硫酸反应的实验研究。
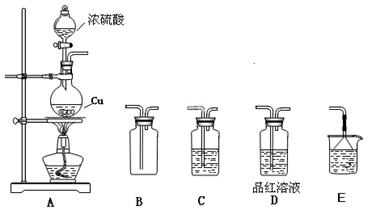
(1)装置A中发生反应的化学方程式?;
(2)若要使B 中收集满干燥的SO2气体(并证实B中已收集满),则上述装置的连接顺序为:?接?接??接?接?(用字母表示);
(3)C 中盛放的试剂是?,证明B 中已收集满SO2的现象是?;
(4)待烧瓶中充分反应后,同学们发现铜有剩余,经检测发现硫酸也有剩余。检验硫酸有剩余的方法是?___________________;
(5)在不补充浓硫酸的前提下,为使铜进一步溶解,可向烧瓶中加入? ________(填序号)。① 盐酸 ?② FeSO4? ③ Fe2O3? ④KNO3
4、填空题 开源节流是应对能源危机的重要举措.
(1)下列做法有助于能源“开源节流”的是______(填字母).
a.大力开采煤、石油和天然气以满足人们日益增长的能源需求
b.大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源
c.开发太阳能、水能、风能、地热等新能源、减少使用煤、石油等化石燃料
d.减少资源消耗,增加资源的重复使用、资源的循环再生
(2)氢能是理想的清洁能源.下列制氢的方法中,最节能的是______(填字母).
a.电解水制氢:2H2O
2H2↑+O2↑
b.高温使水分解制氢:2H2O2H2↑+O2↑
c.太阳光催化分解水制氢:2H2O2H2↑+O2↑
d.天然气制氢:CH4+H2OCO+3H2
(3)利用MnFe2O4通过两步反应使水分解制氢气,第一步反反应为:MnFe2O4MnFe2O4-X+O2,则第二步反应的化学方程式为______(条件不写).
(4)如图是以SO2、I2、H2O为原料,利用核能使水分解制氢气的一种流程.
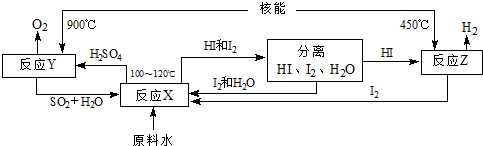
反应X的化学方程式为______,该流程中循环使用的原料有______.从理论上讲,该流程中,1mol原料水制得______molH2.
5、实验题 (9分)有两个实验小组的同学探究一氧化碳、二氧化硫与过氧化钠的反应。请回答下列问题:
(1)第一小组同学设计如图装置进行实验。通入SO2气体,将带余烬的木条插入试管C中,木条复燃。

甲同学认为Na2O2与SO2反应生成了Na2SO3和O2,则反应的化学方程式为___________________________。
乙同学认为Na2O:与SO2反应除了生成Na2SO3和O2外,还有Na2SO4生成。为检验是否有Na2SO4生成,该同学设计了如下方案:

你认为乙同学的方案是否合理____________(答“是”或“否”);请简要说明两点理由:
①__________________________________________________________________________
②__________________________________________________________________________.
(2)第二小组同学利用下图中的有关装置(固定装置及胶管略去)验证CO气体能否与Na2O2反应。已知:H2C2O4  ?CO2↑+CO↑+H2O
?CO2↑+CO↑+H2O
(乙二酸)?

若CO能够与Na2O2发生反应,则预测反应产物为______________________;验证该产物可选择的试剂是___________________________________________________。
上述实验中选择的最简单的装置接口连接顺序为_________________________.