微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 反应4A(g) + 5B(g) 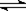 ?4C(g) + 6D(g) △H =-Q kJ/mol,在一定温度下达到化学平衡状态时,下列说法正确的是:(?)
?4C(g) + 6D(g) △H =-Q kJ/mol,在一定温度下达到化学平衡状态时,下列说法正确的是:(?)
A. 若增大压强,A和B的转化率都增大
B. 若升高温度最终能生成更多的C和D
C. 单位时间里有4n mol A消耗,同时有5n mol B生成
D. 容器里A、B、C、D的浓度比是4:5:4:6
参考答案:C
本题解析:略
本题难度:简单
2、选择题 相同温度下,在体积相等的二个恒容密闭容器中发生可逆反应:
N2 (g)+3H2(g) 2NH3(g)△H=" —92.4" kJ/mol。
2NH3(g)△H=" —92.4" kJ/mol。
实验测得起始、平衡时的有关数据如下表:
容器编号
| 起始时各物质物质的量/mol
| 达平衡时反应中的能量变化
|
N2
| H2
| NH3
|
①
| 1
| 3
| 0
| 放出热量a kJ
|
②
| 2
| 6
| 0
| 放出热量bkJ?
|
下列叙述正确的是(?)
A.放出热量关系:b>2a? B.放出热量关系:b =2a
C.达平衡时氨气的体积分数:①>②? D.N2的转化率:①<②
参考答案:AD
本题解析:容器②相当于在容器①的基础上增大压强,平衡向逆反应方向移动,所以容器②中反应物的转化率高,因此A、D正确,BC是错误的,答案选AD。
本题难度:一般
3、填空题 在某温度下,A+B 2C反应达到化学平衡。
2C反应达到化学平衡。
(1)升高温度时,C的物质的量浓度减小,则正反应是 热反应,υ(正) ?,
υ(逆) (“减慢”或“加快”),平衡向 移动。
(2)若B为气态,增大压强平衡不发生移动,则A是 态,C是 态。
(3)若增减B的量,平衡不发生移动,则B是 态。
参考答案:⑴放?加快?加快?逆反应方向;⑵气?气;⑶固或纯液态。
本题解析:依据平衡移动原理,升高温度时,C的物质的量浓度减小,平衡向逆反应方向移动,则正反应放热反应,υ(正)、υ(逆)都加快;若B为气态,增大压强平衡不发生移动,则说明反应前后气体系数相等,故A、C也必需是气体;若增减B的量,平衡不发生移动,说明若增减B的量没有引起B的浓度的改变,故B应为固体或纯液态。
本题难度:一般
4、选择题 对于反应4Fe(OH)2(s)+2H2O(l)+O2(g)=4Fe(OH)3(s) ΔH=-444.3?kJ·mol-1 ΔS=-280.3?kJ·mol-1·K?-1,在常温、常压下反应能自发进行,对反应方向起决定性作用的是
A.熵变
B.温度
C.压强
D.焓变
参考答案:D
本题解析:依据△H-T△S<0,反应能自发进行。说明焓变和熵变是判断反应的两个主要因素,但当△H <0,△S<0,低温下反应自发进行,则说明此时焓变对反应的方向起决定作用。
本题难度:一般
5、选择题 下列叙述能肯定判断某化学平衡发生移动的是(?)
A.反应混合物的浓度改变
B.反应混合物的压强改变
C.正、逆反应速率改变
D.反应物的转化率改变
参考答案:D
本题解析:化学反应达平衡的标志,是正向速率等于逆向速率,A项中混合物的浓度若成比例,按反应系数比改变,反应速率改变,平衡不移动。等物质的量的气相反应,如果增大或减小反应体系的容积,反应混合物的压强改变,但平衡不移动,因此B项也不正确。C项中正、逆反应速率同等程度变化,平衡也不移动,例如催化剂对平衡无影响。
本题难度:简单