萃取
参考答案:C
本题解析:苯中混有苯酚加入溴水后苯酚与溴水生成沉淀,但是溴易溶于苯,会在苯中引入新的杂质溴,A错误;乙烷中混有乙烯通入酸性高锰酸钾溶液中后乙烯与酸性高锰酸钾反应生成二氧化碳,在乙烷中引入了新杂质二氧化碳,所以B错误;乙酸乙酯中混有乙酸,加入饱和碳酸钠溶液中后乙酸与碳酸钠反应,溶于溶液中,乙酸乙酯在饱和碳酸钠溶液中的溶解度较小,可以通过分液的方法分离,C正确;苯和溴苯相互溶解所以无法进行萃取实验,D错误;答案选C。
本题难度:简单
2、实验题 某同学利用铁与水蒸气反应后的固体物质进行了如下实验:?
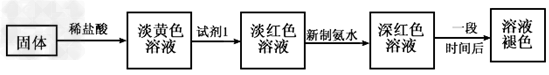
(1)固体溶于盐酸的化学方程式为________________;
(2)试剂1的化学式是____________;加入试剂1后呈红色的原因是(用离子方程式表示):_________________。
(3)加入新制氯水后溶液红色加深的原因是(用离子方程式表示):_____________。
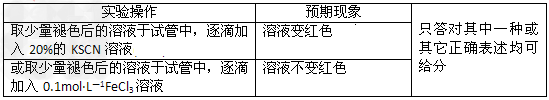
(4)某一同学在实验中由于加入了过量新制氯水,放置一段时间后,发现深红色褪去,为了探究溶液褪色的原因,另有四位同学进行了下表的猜想,你认为丁同学的猜想会是什么?

为验证乙同学的猜想是合理的,请你根据此结论完成下表的实验设计方案。可选用试剂:浓硫酸、1.0mol·L-1 HNO3、1.0mol·L-1盐酸、1.0mol·L-1 NaOH溶液、0.1mol·L-1 FeCl3溶液、0.1mol·L-1 CuSO4溶液、20%KSCN溶液、蒸馏水。

参考答案:(1)Fe3O4?+?8HCl?=2FeCl3?+?FeCl2?+?4H2O?
(2)KSCN?,?Fe3+?+?3SCN-?=?Fe(SCN)3?
(3)2Fe2++Cl2?=?2Fe3++2Cl-
(4)丁的猜想是:溶液中的+3?价铁被氧化为更高的价态?
本题解析:
本题难度:一般
3、选择题 下列实验装置是探究铜丝与过量浓硫酸的反应,下列叙述正确的是 (?)

A.上下移动①中铜丝可控制SO2的量
B.②中品红溶液不褪色
C.③中石蕊溶液变蓝色
D.为确认CuSO4生成,向①中加水,观察溶液颜色
参考答案:A
本题解析:在加热的条件下,当铜丝与浓硫酸接触时才能反应,当往上抽动铜丝时,铜丝与硫酸不接触,反应停止,故可通过上下移动①中铜丝可控制SO2的量,故A正确;SO2具有漂白性,品红能被二氧化硫漂白,可用品红溶液验证SO2的生成,故B不正确;SO2为酸性气体,溶于水显酸性,能使石蕊溶液变红色,故C不正确;铜与浓硫酸的反应Cu+2H2SO4 ?CuSO4+SO2↑+2H2O,实验中,铜丝与过量浓硫酸的反应生成是硫酸铜,试管中含有大量水,不会生成白色固体,CuSO4溶液呈蓝色,为确认CuS04生成,无须向①中加水,故D错误,答案选A。 ?CuSO4+SO2↑+2H2O,实验中,铜丝与过量浓硫酸的反应生成是硫酸铜,试管中含有大量水,不会生成白色固体,CuSO4溶液呈蓝色,为确认CuS04生成,无须向①中加水,故D错误,答案选A。
点评:该题是中等难度的试题,试题基础性强,紧扣教材,意在巩固学生的基础,提高学生的实验分析和探究能力,有利于培养学生的学习兴趣,激发学生的学习积极性。答题时注意二氧化硫的酸性和漂白性。
本题难度:简单
4、实验题 为了测定气体摩尔体积,用如图所示的装置和下列实验药品:将一定量锌片与足量的稀硫酸在试管A中反应,量气管B是由甲、乙两根玻璃管组成,它们用橡皮管连通,并装适量水,甲管有刻度,甲、乙管可固定在铁架台上,供量气用,乙管可上下移动,以调节液面高低。回答下列问题

(1)写出锌和稀硫酸反应的化学方程式:________________________。
(2)如果发生反应的锌片质量为0.260克,实验测得生成的氢气体积为92 mL,则此状况下的气体摩尔体积为_________L/mol。
(3)如果在此实验条件下,甲管的刻度最大值是100 mL,则实验中称取锌片的最大质量是___________克。
(4)为了准确地测量H2的体积,在读取反应后甲管中液面的读数时,应注意__________(填写序号)。
A.视线与凹液面最低处相平
B.等待片刻,待乙管液面不再上升时读数
C.读数时应上、下移动乙管,使甲、乙两管液面相平
D.读数不一定使甲、乙两管液面相平
参考答案:(l)Zn+H2SO4 =ZnSO4+H2↑
(2)23.0
(3)0.283
(4)ABC
本题解析:
本题难度:一般
5、填空题 (1)现有废铜屑和废硫酸,请从原料的利用率和环保的角度分析,设计一个制取胆矾(CuSO4?5H2O)的合理方案,只用化学方程式说明
第一步:______
第二步:______
第三步:过滤,加热浓缩,冷却结晶______
(2)有人建议用铜和稀硫酸混合在加热的条件下不断通入空气以制得硫酸铜溶液,请写出该反应的化学方程式______.
参考答案:(1)以废铜屑和废硫酸为原料,从原料的利用率和环保的角度分析,设计制取胆矾(CuSO4?5H2O)的方案应:铜与氧气反应生成氧化铜,再由氧化铜与硫酸反应生成硫酸铜,最后过滤,加热浓缩,冷却结晶可得CuSO4?5H2O.
故反应方程式为第一步:2Cu+O2?△?.?2CuO;
第二步:CuO+H2SO4=CuSO4+H2O;
第三步:CuSO4+5H2O=CuSO4?5H2O.
故答案为:2Cu+O2=2CuO;CuO+H2SO4=CuSO4+H2O;CuSO4+5H2O=CuSO4?5H2O.
(2)铜和稀硫酸混合在加热的条件下不断通入空气,反应生成硫酸铜与水,方程式为2Cu+O2+2H2SO4?△?.?2CuSO4+2H2O.
故答案为:2Cu+O2+2H2SO4?△?.?2CuSO4+2H2O.
本题解析:
本题难度:一般
|