微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (6分)混合物由金属M的盐酸盐和其氧化合,以及另一种金属N的氧化物组成。有以下反应关系:

据此判断:
(1)沉淀D的化学式为___________________________________。
(2)反应③的化学方程式为________________________________。
(3)反应①②④的离子方程式为
①__________________________________________________,②___________________________________,④____________________________________。
参考答案:(1)Fe2O3
(2)2Al(OH)3 Al2O3+3H2O
Al2O3+3H2O
(3)①Al2O3+2OH-====2 +H2O
+H2O
②OH-+CO2=
 +2H2O+CO2====
+2H2O+CO2==== +Al(OH)3↓?
+Al(OH)3↓?
④Al3++3NH3·H2O====Al(OH)3↓+3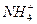
本题解析:由A中各物质的性质可推知B中含Al2O3和Fe2O3,C中溶质为KAl(SO4)2。反应④为Al3+与NH3·H2O生成Al(OH)3,故G为Al(OH)3。B中Al2O3与NaOH反应,故D为Fe2O3,E中含 和过量的OH-。由此推知,
和过量的OH-。由此推知, 与CO2反应生成Al(OH)3,这是由于Al(OH)3比H2CO3酸性弱的缘故,同时由于CO2过量,反应②应生成
与CO2反应生成Al(OH)3,这是由于Al(OH)3比H2CO3酸性弱的缘故,同时由于CO2过量,反应②应生成 。反应③为Al(OH)3受热分解生成Al2O3和H2O。
。反应③为Al(OH)3受热分解生成Al2O3和H2O。
本题难度:一般
2、选择题 下列金属冶炼的反应原理,错误的是(?)
A.2NaCl(熔融) 2Na+Cl2?
2Na+Cl2?
B.MgO+H2 Mg+H2O
Mg+H2O
C.Fe3O4+4CO  3Fe+4CO2
3Fe+4CO2
D.2HgO  2Hg+O2?
2Hg+O2?
参考答案:B
本题解析:钠、镁等活泼的金属,要通过电解法进行冶炼,所以A正确,B不正确。不活泼的金属通过热分解即可,D正确。介于中间的金属,一般通过还原剂还原进行冶炼,C正确。答案选B。
本题难度:简单
3、选择题 CuI是一种不溶于水的白色固体,它可以由反应:2Cu2++4I-=2CuI↓+I2而得到。现以石墨为阴极,以Cu为阳极电解KI溶液,通电前向电解液中加入少量酚酞和淀粉溶液。电解开始不久,阴极区溶液呈红色,而阳极区溶液呈蓝色,同时有白色沉淀生成。下列说法中正确的是
A.对阳极区溶液呈蓝色的正确解释是:2I--2e-=I2,碘遇淀粉变蓝
B.对阳极区溶液呈蓝色的正确解释是:Cu-2e-=Cu2+,Cu2+显蓝色
C.阴极区溶液呈红色的原因是:2H++2e-=H2↑,使阴极附近OH-浓度增大,溶液显碱性,从而使酚酞变红
D.阴极上的电极反应式为:Cu2++2e-=Cu
参考答案:C
本题解析:铜是阳极,所以阳极是铜失去电子,A不正确;由于铜离子能氧化碘离子,生成单质碘碘遇淀粉变蓝,B不正确;阴极是得到电子的,所以选项C正确,D不正确,答案选C。
本题难度:简单
4、选择题 下列有关金属及化合物的说法正确的是
A.地壳中含量最多的元素是铝元素;
B.在自然界中铝以化合态存在;
C.NaCl的焰色反应呈紫色;
D.白色絮状沉淀Fe(OH)2可溶于NaOH溶液中。
参考答案:B
本题解析:A 错误,地壳中含量最多的元素是氧元素
B 正确,铝很活泼,在自然界中以化合态存在
C 错误,NaCl的焰色反应呈黄色
D 错误,白色絮状沉淀Fe(OH)2不能溶于NaOH
本题难度:一般
5、填空题 (16分)铁及其化合物在生活、生产中有广泛应用。请回答下列问题:

(1)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为
3FeS2+8O2 ==6SO2+Fe3O4,氧化产物为?,若有3 mol FeS2参加反应,
==6SO2+Fe3O4,氧化产物为?,若有3 mol FeS2参加反应,
转移?mol电子。
(2)氯化铁溶液常用作印刷电路铜板腐蚀剂,反应的离子方程式为?。
(3)与明矾相似,硫酸铁也可用作净水剂,其原理为?(用离子方程表示)?
(4)①钢铁的电化腐蚀简单示意图如右,将该图稍作修改即可成为钢铁电化学防护的简单示意图,请在下图虚线框内作出修改,并用箭头标出电子流动方向。
②写出修改前的钢铁吸氧腐蚀石墨电极的电极反应式?。
(5)铁红是一种红色颜料,其成分是Fe2O.3将一定量的铁红溶于160ml5 mol·L—1盐酸中,在加入一定量铁粉恰好溶解,收集到2.24L(标准状况),经检测,溶夜中无Fe3+,则参加反应的铁粉的质量为?。
参考答案:(1)SO2、Fe3O4? 32?(2)2Fe3++Cu=2Fe2++Cu2+?(3)Fe3++3H2O  Fe(OH)3胶体+3H+
Fe(OH)3胶体+3H+
(4)①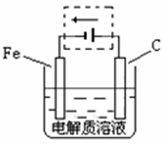 ?②O2+2H2O+4e-=4OH-?(5)11.2g
?②O2+2H2O+4e-=4OH-?(5)11.2g
本题解析:(1)根据方程式可知,FeS2中Fe和S的化合价分别从+2价升高到+8/3价和从-1价升高到+4价,所以FeS2是还原剂,SO2和四氧化三铁都是氧化产物;若有3 mol FeS2参加反应,转移电子的物质的量是(2+6×5)=32mol。
(2)铁离子具有氧化性,能氧化单质铜,方程式2Fe3++Cu=2Fe2++Cu2+。
(3)硫酸铁溶于水电离出的铁离子能水解生成氢氧化铁胶体,胶体具有吸附性,所以可作净水剂,方程式为Fe3++3H2O  Fe(OH)3胶体+3H+。
Fe(OH)3胶体+3H+。
(4)①该装置是铁的电化学腐蚀,所以要保护铁,则可以通过外接电流的阴极保护法,即铁和电源的负极,作阴极,碳和电源的正极相连,作阳极,如同所示。
②原电池中负极失去电子,正极得到电子,所以正极反应式是O2+2H2O+4e-=4OH-。
(5)盐酸是0.8mol,生成的氢气是0.1mol,所以和氧化铁中氧元素结合的氢原子是0.6mol,因此氧化铁是0.1mol,生成0.2mol氯化铁。0.2mol氯化铁消耗铁是0.1mol,生成氢气消耗铁是0.1mol,所以参加反应的铁是0.2mol,质量是11.2g。
本题难度:一般