微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 为了除去FeCl2溶液中混有的少量FeCl3,最好的方法是向此溶液中
A.通入氯气
B.加入Zn
C.加入Fe
D.加入Cu
参考答案:C
本题解析:除杂的前提是加入试剂不能与FeCl2反应,排除AB:2FeCl2+Cl2=2FeCl3? Zn+FeCl2=ZnCl2+Fe;
再者是不能引入杂质离子,排除D:Cu+2FeCl3=CuCl2+2FeCl2
故答案为C:2FeCl3+Fe=3FeCl2
本题难度:一般
2、选择题 ag铁粉与含有H2SO4的CuSO4溶液完全反应后,固体质量与反应前相同, 则
参加反应的CuSO4与H2SO4的物质的量之比为
A.1 :7
B.7 :1
C.7 :8
D.8 :7
参考答案:B
本题解析:设铁的物质的量是x,消耗的硫酸的物质的量是y,
Fe先与CuSO4反应,再与H2SO4反应,
因为a/56 > a/64,所以CuSO4反应完全, 剩余Fe与H2SO4反应,
则由定量关系得:
Fe----Cu
x? (a/64)mol
则x=(a/64)mol
Fe-------------------H2SO4
(a/56-a/64)mol?y
则y=(a/56-a/64)mol
所以
n(CuSO4):n(H2SO4)=x:y=(a/64):(a/56-a/64) =7:1。
故选B。
点评:此题要特别注意过量和不足的问题,计算之前就要根据条件作出判断。
本题难度:简单
3、填空题 (16分)铁及其化合物在生活、生产中有广泛应用。请回答下列问题:

(1)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为
3FeS2+8O2 ==6SO2+Fe3O4,氧化产物为?,若有3 mol FeS2参加反应,
==6SO2+Fe3O4,氧化产物为?,若有3 mol FeS2参加反应,
转移?mol电子。
(2)氯化铁溶液常用作印刷电路铜板腐蚀剂,反应的离子方程式为?。
(3)与明矾相似,硫酸铁也可用作净水剂,其原理为?(用离子方程表示)?
(4)①钢铁的电化腐蚀简单示意图如右,将该图稍作修改即可成为钢铁电化学防护的简单示意图,请在下图虚线框内作出修改,并用箭头标出电子流动方向。
②写出修改前的钢铁吸氧腐蚀石墨电极的电极反应式?。
(5)铁红是一种红色颜料,其成分是Fe2O.3将一定量的铁红溶于160ml5 mol·L—1盐酸中,在加入一定量铁粉恰好溶解,收集到2.24L(标准状况),经检测,溶夜中无Fe3+,则参加反应的铁粉的质量为?。
参考答案:(1)SO2、Fe3O4? 32?(2)2Fe3++Cu=2Fe2++Cu2+?(3)Fe3++3H2O  Fe(OH)3胶体+3H+
Fe(OH)3胶体+3H+
(4)①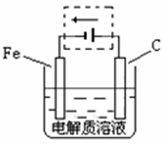 ?②O2+2H2O+4e-=4OH-?(5)11.2g
?②O2+2H2O+4e-=4OH-?(5)11.2g
本题解析:(1)根据方程式可知,FeS2中Fe和S的化合价分别从+2价升高到+8/3价和从-1价升高到+4价,所以FeS2是还原剂,SO2和四氧化三铁都是氧化产物;若有3 mol FeS2参加反应,转移电子的物质的量是(2+6×5)=32mol。
(2)铁离子具有氧化性,能氧化单质铜,方程式2Fe3++Cu=2Fe2++Cu2+。
(3)硫酸铁溶于水电离出的铁离子能水解生成氢氧化铁胶体,胶体具有吸附性,所以可作净水剂,方程式为Fe3++3H2O 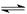 Fe(OH)3胶体+3H+。
Fe(OH)3胶体+3H+。
(4)①该装置是铁的电化学腐蚀,所以要保护铁,则可以通过外接电流的阴极保护法,即铁和电源的负极,作阴极,碳和电源的正极相连,作阳极,如同所示。
②原电池中负极失去电子,正极得到电子,所以正极反应式是O2+2H2O+4e-=4OH-。
(5)盐酸是0.8mol,生成的氢气是0.1mol,所以和氧化铁中氧元素结合的氢原子是0.6mol,因此氧化铁是0.1mol,生成0.2mol氯化铁。0.2mol氯化铁消耗铁是0.1mol,生成氢气消耗铁是0.1mol,所以参加反应的铁是0.2mol,质量是11.2g。
本题难度:一般
4、选择题 完全溶解28.4 g碳酸铜和氢氧化铜的混合物需要消耗1 mol·L-1的盐酸500 mL。若灼烧相同质量的上述混合物,能得到氧化铜的质量为
A.40 g
B.30 g
C.20 g
D.16 g
参考答案:C
本题解析:依题意,按盐酸与氧化铜关系式速算:
CuO?—? 2HCl(由CuCl2产物推之)
80 g? 2 mol
x? 1 mol·L-1×0.5 L
解之:x="20" g
本题难度:简单
5、填空题 铁及其化合物在日常生活中应用广泛,请回答下列问题:
(1)Fe(NO3)3·9H?2?O易溶于水,微溶于硝酸,主要用作催化剂和媒染剂,工业上用细铁屑与稀硝酸反应制备,主要流程如下:
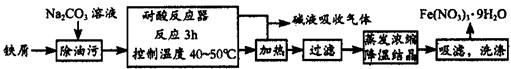
①Na2CO3溶液可以除油污,原因是(用离子方程式表示)_________________________;
②耐腐反应器中可以观察到如下的现象:铁屑__________,溶液颜色变为__________,有______色气体产生;制备过程中需控制加入铁屑的量,当观察到_______________的现象时应停止加入铁屑;
③制得的Fe(NO3)3·9H?2?O用20% HNO3洗涤,其原因是_________________________。
④若在实验中进行蒸发浓缩、降温结晶的操作,除带铁圈的铁架台、坩埚钳外,还需要的主要仪器有___________。
(2)某兴趣小组在实验室用细铁屑和稀硝酸制备Fe(NO3)3,装置如右图所示(固定所用仪器和加热装置未画出)。
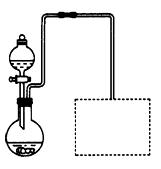
①该实验中对圆底烧瓶加热的最佳方式用_ _________加热;
_________加热;
②装置中圆底烧瓶上方长导管的作用是_________________;
③请在图中虚线框内画出防止倒吸的尾气吸收装置。(提示:碱液可快速、充分吸收产生的氮的氧化物气体)
参考答案:(1) ① CO32-+ H2O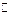 HCO3-+OH-(2分)
HCO3-+OH-(2分)
② 溶解,黄色,无,反应器中产生气泡的速率明显变慢(4分)
③ 洗去晶体表面附着的杂质且降低洗涤过程中晶体的消耗(2分)
④ 酒精灯、蒸发皿、玻璃棒(2分)
(2) ①水浴(2分)?②导气兼冷凝回流(2分)
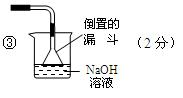
本题解析:略
本题难度:一般