微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 氨基甲酸铵(NH2COONH4)是一种白色固体,易分解、易水解,可用做肥料、灭火剂、洗涤剂等。某化学兴趣小组模拟工业原理制备氨基甲酸铵,反应的化学方程式如下:2 NH3(g)+CO2(g)  ?NH2COONH4(s)? ΔH<0
?NH2COONH4(s)? ΔH<0
(1)实验室制备NH3的化学方程式是:?。
(2)制备氨基甲酸铵的装置如下图所示,把氨气和二氧化碳通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵小晶体悬浮在四氯化碳中。当悬浮物较多时,停止制备。
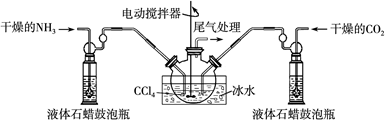
注:四氯化碳与液体石蜡均为惰性介质。
①发生器用冰水冷却的原因是?。液体石蜡鼓泡瓶的作用是?。
②从反应后的混合物中分离出产品的实验方法是?(填写操作名称)。为了得到干燥产品,应采取的方法是?(填写选项序号)。
a. 常压加热烘干? b. 高压加热烘干? c. 真空40 ℃以下烘干
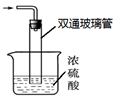
③尾气处理装置如右图所示。双通玻璃管的作用:?;?
浓硫酸的作用:? ? ?。
(3)取因部分变质而混有碳酸氢铵的氨基甲酸铵样品0.7825 g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为1.000 g。则样品中氨基甲酸铵的物质的量分数为?。
参考答案:(1)2NH4Cl + Ca(OH)2△2NH3 ↑+ CaCl2 + 2H2O(未写条件扣1分)(2分)
(2)① 降低温度,提高反应物转化率(或降低温度,防止因反应放热造成产物分解)(2分);通过观察气泡,调节NH3与CO2通入比例(2分)② 过滤(1分)? c(1分)
③防止倒吸(2分)吸收多余氨气,防止空气中水蒸气进入反应器使氨基甲酸铵水解(2分)
(3)75%(3/4、0.75,其它结果不给分)(3分)
本题解析:(1)实验室制备NH3的化学方程式是2NH4Cl + Ca(OH)2 2NH3 ↑+ CaCl2 + 2H2O。
2NH3 ↑+ CaCl2 + 2H2O。
(2)①因为反应放热,降低温度,提高反应物转化率,同时,防止因反应放热造成产物分解;通过观察气泡,调节NH3与CO2通入比例②反应后的固体和液体的混合物,分离出产品的实验方法是过滤。因为氨基甲酸铵热稳定性差,为了得到干燥产品,应采取的方法是真空40 ℃以下烘干;③图中尾气处理装置使用了截面积较大的玻璃管,可防止倒吸;浓硫酸可以吸收多余氨气,防止空气中水蒸气进入反应器使氨基甲酸铵水解。
(3)由NH2COONH4——CaCO3可知0.7825 g NH2COONH4是0.0133mol,1.000 g CaCO3是0.01mol,样品中氨基甲酸铵的物质的量分数为75%。
本题难度:一般
2、填空题 某兴趣小组用下图装置探究氨的催化氧化
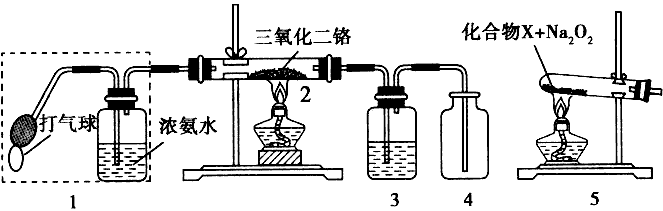
(1)氨催化氧化的化学方程式为________________。
(2)加热玻璃管2一段时间后,挤压1中打气球鼓入空气,观察到2中物质呈红热状态;停止加热后仍能保持红热,该反应是____反应(填“吸热”或“放 热”)。
(3)为保证在装置4中观察到红棕色气体,装置3应装入_____;若取消3,在4 中仅观察到大量白烟,原因是___________________。
(4)为实现氨催化氧化,也可用装置5替换装置____(填装置代号);化台物X 为____(只写一种),Na2O2的作用是____。
参考答案:(1)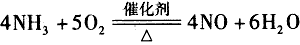
(2)放热
(3)浓H2SO4;生成的NO与O2反应生成NO2,NO2与水反应生成HNO3,NH3与HNO3反应生成了NH4NO3
(4)1;NH4Cl;与HCl反应生成氧气
本题解析:
本题难度:一般
3、实验题 试用实验室提供的下列试剂,设计两个原理不同的简单实验(只要写出两个实验方案即可),证明镁元素的金属性比铝强。试剂:Mg条、Al丝、AlCl3溶液、MgCl2溶液、稀HCl、NaOH溶液
实验方案:①__________________;
实验方案:②__________________。
参考答案:实验方案①:用Mg条和Al丝分别与盐酸反应,观察其反应速率的快慢
实验方案②:将Mg条和Al丝靠在一起,插入稀HCl中,观察其气泡产生的情况
本题解析:
本题难度:一般
4、选择题 下列试剂能用来鉴别KNO3溶液和KCl溶液的是( )
A.BaCl2溶液
B.稀盐酸
C.AgNO3溶液
D.NaOH溶液
参考答案:A、氯化钡和硝酸钾以及氯化钾均不反应,没有现象,不能鉴别,故A错误;
B、盐酸和氯化钾以及硝酸钾均不反应,没有现象,不能鉴别,故B错误;
C、硝酸银可以和氯化钾反应生成白色沉淀氯化银,但是和硝酸钾之间不反应,没有现象,可以鉴别,故C正确;
D、硝酸钾和氯化钾与氢氧化钠均不反应,没有现象,不能鉴别,故D错误.
故选C.
本题解析:
本题难度:简单
5、实验题 下图装置是模拟工业制硝酸 中氨的催化氧化,回答下列问题:
中氨的催化氧化,回答下列问题:
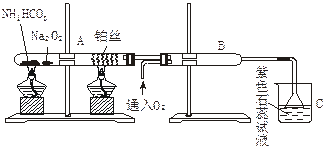
(1)在受热的试管A中NH4HCO3发生反应的化学方程式为:____________________。
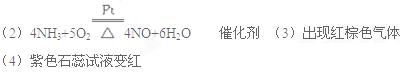
(2)被加热的铂丝处发生的化学方程式为_______________;铂丝的作用是_______。
(3)B中出现的现象为:___________________________________________________。
(4)烧杯C中发生的现象为________________________________________________。
参考答案:(1)略
本题解析:略
本题难度:一般