微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 已知过氧化钠与水的反应分两步进行,第一步是过氧化钠与水反应生成过氧化氢和氢氧化钠;第二步是过氧化氢分解生成水和氧气。某校合作学习探究小组对过氧化钠与水的反应进行了再探究。将过氧化钠与一定量的水反应,有气泡放出,将所得的浓溶液分成四份,分别进行实验探究:

试回答:
(1)按要求写出下列反应的化学方程式:
①过氧化钠与水反应生成过氧化氢和氢氧化钠:_______________________________。
②在二氧化锰作用下过氧化氢发生分解反应:_______________________________。
(2)根据B、D两个实验,回答D实验中酚酞试液不变红的原因是_____________________________。
(3)综合考虑,回答A实验中酚酞试液不变红的原因可能是:
①_______________________;②_________________________。
参考答案:(1)①Na2O2+2H2O==2NaOH+H2O2;②2H2O2 2H2O+O2↑
2H2O+O2↑
(2)H2O2有漂白性(或强氧化性)
(3)H2O2有漂白性(或强氧化性);NaOH的浓度大或OH-的浓度大
本题解析:
本题难度:困难
2、实验题 有人设计了如下图所示的实验装置,目的是做钠与水反应的实验并验证:①钠的物理性质;②钠与水反应的产物是什么。
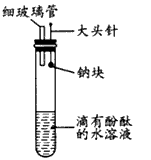
(1)当进行适当操作时还需要的仪器有____。
(2)如何进行操作?
(3)实验现象是___。
参考答案:(1)小试管和酒精灯
(2)将大头针向上提,使钠块落入水中,将小试管扣在导管上收集反应产生的气体,用拇指堵住小试管口移近酒精灯,松开拇指点燃小试管中的气体
(3)钠浮在水面上很快熔化成闪亮的小球,并逐渐消失,水溶液由无色变成红色,点燃小试管中的气体时,有尖锐的爆鸣声
本题解析:
本题难度:一般
3、简答题 某科研小组设计出利用工业废酸(10%H2SO4)来堆浸某废弃的氧化铜锌矿的方案,实现废物综合利用,方案如图所示.

已知:各离子开始沉淀及完全沉淀时的pH如下表所示.
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH
Fe2+
6.34
9.7
Fe3+
1.48
3.2
Zn2+
6.2
8.0
|
请回答下列问题:
(1)氧化铜锌矿中含有少量的CuS和ZnS,在H2SO4的作用下ZnS可以溶解而CuS不溶,则相同温度下:Ksp(CuS)______?Ksp(ZnS)(选填“>”“<”或“=”).
(2)物质A可使用下列物质中的______.
A.KMnO4?B.O2?C.H2O2?D.Cl2
(3)除铁过程中加入氨水的目的是调节溶液的pH,pH应控制在______范围之间.
(4)物质B可直接用作氮肥,则B的化学式是______.
(5)除铁后得到的Fe(OH)3可用KClO溶液在碱性环境将其氧化得到一种高效的多功能水处理剂--K2FeO4,写出该反应的离子方程式______.
参考答案:(1)相同条件下,溶解度大的物质先溶解,因在H2SO4的作用下ZnS可以溶解而CuS不溶,则相同温度下:Ksp(CuS)<Ksp(ZnS),故答案为:<;
(2)除铁过程中加入A和氨水,使亚铁离子变成氢氧化铁沉淀,故A应为氧化剂,考虑不引入新的杂质,应选BC,故答案为:BC;
(3)从图表数据可知,铁离子沉淀完全的PH为3.2,锌离子开始沉淀的PH为6.2.故除铁PH范围为:3.2~6.2;
(4)因所用废酸为硫酸,B又可作氮肥,所以B为NH4)2SO4,故答案为:(NH4)2SO4;
(5)由题给信息可知,反应物为2Fe(OH)3、ClO-、OH-,生成物之一为FeO42-,因铁在反应中化合价升高,故氯的化合价降低,故另一产物为Cl-,根据元素守恒,还有水是产物.根据化合价升降法配平此方程式为:2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O.
本题解析:
本题难度:一般
4、实验题 课本实验设计得简要明了,但也常存在一些不足,在学习过程中对其进行分析与改进是研究性学习的一个重要课题。
Ⅰ.草酸晶体(H2C2O4·2H2O)受热易分解(分解温度为175℃),产生CO和CO2。关于草酸晶体受热分解及验证部分分解产物的实验装置如图。

(1)写出草酸晶体受热分解的化学方程式:
?__________。
(2)设计该装置欲验证的分解产物是?。
(3)草酸晶体的某些物理性质如下表:
?
| 分子式
| 颜色、状态
| 水溶性
| 熔点/℃
| 密度/g·cm—3
|
草酸晶体
| H2C2O4·2H?2O
| 无色晶体
| 易溶于水
| 101.5
| 1.650
|
有同学认为,用该装置进行实验,存在着不合理因素,请分析指出(任答两点):
①?
②?
Ⅱ.下图甲是 “铜丝在氯气中燃烧”的演示实验,铜丝在氯气中燃烧的主要现象是?。有人对该实验提出了如下改进方案:
①按下图乙所示连接好装置,并检查气密性;

②取下注射器并集满Cl2;
③点燃酒精灯加热1~2min后,再移开酒精灯。迅速将注射针插入石英玻璃管内,并将Cl2缓缓推入玻璃管中;
④拔出针头,再用同样方法快速向玻璃管中推入空气。请回答:
(1)步骤③中,移开酒精灯、推入Cl2时,观察到铜丝继续保持红热状态,由此可判断,该反应为?反应(填“放热”或“吸热”)。
 ?(2)步骤④完成后,发现乙试管中的蒸馏水变为蓝绿色。此时缓缓拉动活塞,使少量NaOH溶液吸入乙试管中,看到试管中有?色的沉淀产生,该反应的离方程式为?。
?(2)步骤④完成后,发现乙试管中的蒸馏水变为蓝绿色。此时缓缓拉动活塞,使少量NaOH溶液吸入乙试管中,看到试管中有?色的沉淀产生,该反应的离方程式为?。
(3)改进后的实验与课本实验相比较,其优点为?
?______________。
参考答案:(共15分)I.(1)H2C2O4·2H2O? →? 3H2O+CO↑+CO2↑(2分)
(2)CO2(1分)
(3)①草酸晶体在未达分解温度之前已熔化成液体而流出,使实验难以进行。(2分)
②CO会污染空气,而该装置未考虑尾气处理。(2分)
II.产生棕黄色的烟;(2分)
(1)放热;(1分)(2)蓝;(1分)? Cu2++2OH-====Cu(OH)2↓(2分)
(3)防止了氯气、氯化铜颗粒逸散到空气中所带来的污染。(2分)
本题解析:略
本题难度:简单
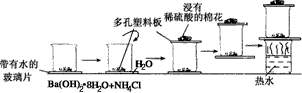
5、实验题 某同学设计如图的实验方案来探究NH4Cl和Ba(OH)2·8H2O反应中的能量变化。根据他的实验步骤填写对应的实验现象和结论。
(1)列表整理实验事实和结论

(2)问题讨论
①实验中为何要在晶体混合后立即用玻璃棒快速搅拌混合物?_________________________________________
②在实验中即使不结冰,将烧杯拿起时烧杯与玻璃片也可能粘在一起。怎样用简单方法说明烧杯与玻璃片之间是因结冰而粘在一起的?__________________________________________________________
③浸有稀H2SO4的棉花有何作用?__________________________________________________
参考答案:(1) (2)
(2)
①使反应物迅速充分地反应,并使温度迅速下降。
②将烧杯和玻璃片提起,从侧面轻推玻璃片,若玻璃片能发生相对滑动,则说明烧杯和玻璃片是因水粘在一起的,若不能相对滑动,则为冰所冻结。
③吸收生成的氨气。
本题解析:
本题难度:一般